Правило октету
Прáвило октéту (Г. Льюїс, 1916) — класичне правило для опису електронної конфігурації атомів у молекулах: максимальна кількість електронних пар, здатна накопичитися у валентній оболонці атомів 2-го періоду періодичної системи, становить 4 (кількість електронів, отже, становить 8, звідси назва правила: лат. octo — вісім). Для атомів 3-го і подальших періодів забагато винятків із цього правила.
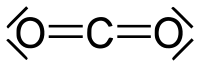
Правило октету відіграло важливу роль у становленні понять валентності, хімічного зв'язку та електронної пари, але розвинута невдовзі квантова теорія будови електронної оболонки атома залишила цьому правилу лише історичне значення. З позицій квантової теорії зрозуміло, що 8 електронів відповідають цілком заповненим валентним s- та p-підоболонкам атома, і винятки з цього правила обумовлені участю d-орбіталей в утворенні ковалентного зв'язку.
Див. також
Джерела
- IUPAC Gold Book. Lewis octet rule. Процитовано 22 жовтня 2014. (англ.)
- Gilbert N. Lewis. (1916). The Atom and the Molecule. J. Am. Chem. Soc. 38: 762–785. doi:10.1021/ja02261a002. (англ.)
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.