Піперидин
Піпериди́н (англ. Piperidine) — шестичленний насичений гетероцикл з одним атомом Нітрогену, повністю гідрований аналог піридину. Безбарвна рідина з характерним неприємним запахом. Цикл піперидину входить до складу анальгетичного препарату — тримеперидину та нейролептичного — галоперидолу.
Піперидин — структурний фрагмент алкалоїду чорного перця (Piper nigrum) піперину.
| Піперидин | |
|---|---|
 |
 |
| Назва за IUPAC | Піперидин |
| Інші назви | азациклогексан, гексагідропіридин, азинан |
| Ідентифікатори | |
| Номер CAS | 110-89-4 |
| Номер EINECS | 203-813-0 |
| KEGG | C01746 |
| ChEBI | 18049 |
| RTECS | TM3500000 |
| SMILES |
C1CCNCC1[1] |
| InChI |
InChI=1S/C5H11N/c1-2-4-6-5-3-1/h6H,1-5H2 |
| Номер Бельштейна | 102438 |
| Властивості | |
| Молярна маса | 85,148 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 0,8606 г/см³[2][3] |
| Тпл | -11,02 °C[3] |
| Ткип | 106,22 °C[3] |
| Кислотність (pKa) | 11,123[4] |
| Діелектрична проникність (ε) | 4,33[4] |
| Показник заломлення (nD) | 1,4530[2] |
| В'язкість | 1,573 мПа·с[4] |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-86,4 кДж/моль[5][6] |
| Ст. ентропія S |
210,0 Дж/(моль·K)[5] |
| Теплоємність, c |
179,9 Дж/(моль·K)[5] |
| Небезпеки | |
| Температура спалаху | 16 °C |
| Вибухові границі | 1-10% у повітрі |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Отримання
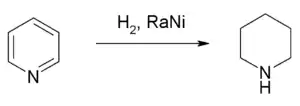
Піперидин синтезують відновленням піридину воднем, який виділяється в результаті взаємодії лужних металів зі спиртами, наприклад, натрію з етанолом (реакція Бірча). А для безпосереднього гідрування застосовують каталізатори на кшталт нікелю Ренея.
Хімічні властивості
Піперидин проявляє значно сильніші осно́вні властивості, аніж піридин. Атоми гідрогену у циклі можуть легко заміщуватися алкільними та ацильними залишками, нітрозогрупою.
Під дією сульфатної кислоти або каталізаторів (нікель Ренея, платинова чернь) піперидин дегідрується до піридину.
Див. також
Примітки
- PIPERIDINE
- При 20 °C
- За тиску 101,3 кПа
- При 25 °C
- У рідкому стані
- У газуватому стані ентальпія утворення складає 47,1 кДж/моль
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.