Пірролізин
Пірролізин (аббр. Pyl або O) неканонічна альфа-амінокислота яка використовується деякими метаногенними бактеріями та археями при біосинтезі білків;[1][2] не використовується при біосинтезі білків еукаріотами. Пірролізин кодується кодоном UAG, який зазвичай виконує роль стоп-кодона (амбер-кодон). Бічний ланцюг пірролізина нагадує лізин та є катіоном за фізіологічних значень pH.
| Пірролізин | |
|---|---|
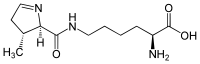 | |
| Систематична назва | N6-{[(2R,3R)-3-метил-3,4-дигідро-2H-піррол-2-yl]карбоніл}-L-лізин |
| Ідентифікатори | |
| Номер CAS | 448235-52-7 |
| KEGG | C16138 |
| ChEBI | 21860 |
| SMILES |
O=C(NCCCC[C@@H](C(=O)O)N)[C@@H]1/N=C\C[C@H]1C |
| InChI |
InChI=1S/C12H21N3O3/c1-8-5-7-14-10(8)11(16)15-6-3-2-4-9(13)12(17)18/h7-10H,2-6,13H2,1H3,(H,15,16)(H,17,18)/t8-,9+,10-/m1/s1 |
| Властивості | |
| Молекулярна формула | C12H21N3O3 |
| Молярна маса | 255,31 г/моль |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Пірролізин як 22-га протеїногенна амінокислота
Майже всі протеїни в земних живих істотах синтезуються тільки з 20 стандартних, або канонічних амінокислот. Ця двадцятка доповнюється двома неканонічними амінокислотами (селеноцистеїн та пірролізин), які також можуть вбудовуватись в білки трансляційною машинерією деяких типів клітин. Пірролізин був відкритий у 2002 році в активному сайті ензима монометиламін метилтрансферази (MtmB) з метан-продукуючої археї Methanosarcina barkeri.[3][4] Пізніше були знайдені ще чотири види архей (Methanosarcina acetivorans, Methanosarcina mazei, Methanosarcina thermophila, Methanococcoides burtoni) та один вид Грам-позитивних бактерій (Desulfitobacterium hafniense) які можуть використовувати пірролізин в біосинтезі білків.[5] В матричній РНК пірролізин кодується кодоном UAG який в інших організмах зазвичай є стоп-кодоном. Спеціальна аміноацил-тРНК-синтетаза ацилює пірролізином додаткову транспортну РНК з антикодоном CUA, внаслідок чого при трансляції мРНК на рибосомі відбувається встроювання пірролізину в поліпептидний ланцюг.[3][5]
Біосентетична машинерія необхідна для біосинтезу пірролізину та пірролізин-вмісних білків кодується в кластері генів pylTSBCD,[6] який також називають пірролізиновим опероном (англ. Pyl operon).[5] Гени pylT та pylS розташовані на початку оперону кодують пірролізинову тРНК та пірролізинову аміноацил-тРНК-синтетазу, відповідно. Гени pylB, pylC та pylD кодують ензими необхідні для біосинтезу пірролізину з лізину.[5] При цьому лише гени pylT та pylS є критично необхідними для функціонування цієї розширеної версії генетичного коду. Так, було показано, що при переносі генів pylT та pylS в інші бактерії (зокрема в E.coli) вони можуть вбудовувати пірролізин в білки у відповідь на UAG-кодон, за умови якщо готовий синтетичний пірролізин додається до поживного середовища.[7]
Каталітична функція
Додаткове гетероциклічне кільце пірролізину зазвичай використовується в активних сайтах деяких метилтрансфераз. Вважається, що це кільце може відносно вільно обертатись. Вважається, що воно бере участь у правильній орієнтації метильної групи метиламіну для взаємодії з корріноїдним кофактором.[4]
Генетичне кодування
Принциповою відмінністю пірролізину від інших неканонічних амінокислот, таких як, наприклад, гідроксилізин, є те що пірролізин вбудовується в білки на стадії трансляції, тоді як інші аналоги лізину та інших амінокислот виникають внаслідок пост-трансляційних перетворень. Позиція пірролізину в поліпептиді керується генетичним кодом, так само як і для канонічних амінокислот. Пірролізин кодується в мРНК кодоном UAG, який у більшості організмів є одним із стоп-кодонів (амбер стоп-кодон). Для цього процесу необхідний ген pylT, який кодує додаткову транспортну РНК (тРНК) з CUA антикодоном, а також гену pylS, який кодує додаткову аміноацил-тРНК-синтетазу, яка прикріплює пірролізин до його тРНК.
Ця нова тРНК-ааРС пара («ортогональна пара») діє незалежно від пар, що відповідають іншим амінокислотам. На основі цієї ортогонально пари були розроблені методи високоточного селективного введення нестандартних хімічних модифікацій в рекомбінантні білки при їх експресії в Escherichia coli або в інших системах.[8][9]
Примітки
- Richard Cammack, ред. (2009). Newsletter 2009. Biochemical Nomenclature Committee of IUPAC and NC-IUBMB. Pyrrolysine.
- Rother, Michael; Krzycki, Joseph A. (1 січня 2010). Selenocysteine, Pyrrolysine, and the Unique Energy Metabolism of Methanogenic Archaea. Archaea 2010. ISSN 1472-3646. PMC 2933860. PMID 20847933. doi:10.1155/2010/453642.
- Gayathri Srinivasan, Carey M. James, Joseph A. Krzycki. Pyrrolysine encoded by UAG in Archaea: charging of a UAG-decoding specialized tRNA // Science. — 2002. — Т. 296. — С. 1459–1462. — DOI:. — PMID:.
- Bing Hao, Weimin Gong, Tsuneo K. Ferguson, Carey M. James, Joseph A. Krzycki, Michael K. Chan. A New UAG-Encoded Residue in the Structure of a Methanogen Methyltransferase // Science. — 2002. — Т. 296. — С. 1462–1466. — DOI:. — PMID:.
- Yan Zhang, Pavel V. Baranov, John F. Atkins, Vadim N. Gladyshev. Pyrrolysine and Selenocysteine Use Dissimilar Decoding Strategies // Journal of Biological Chemistry. — 2005. — Т. 280, № 21. — С. 20740–20751. — DOI:.
- Rother, M; Krzycki, J. A. (17 серпня 2010). Selenocysteine, pyrrolysine, and the unique energy metabolism of methanogenic archaea. Archaea. 453642. с. 1. PMC 2933860. PMID 20847933. doi:10.1155/2010/453642.
- Sherry K. Blight, Ross C. Larue, Anirban Mahapatra, David G. Longstaff, Edward Chang, Gang Zhao, Patrick T. Kang, Kari B. Green-Church, Michael K. Chan, Joseph A. Krzycki. Direct charging of tRNACUA with pyrrolysine in vitro and in vivo // Nature. — 2004. — Т. 431. — С. 333-335. — DOI:.
- Hao, B; Zhao, G; Kang, P. T.; Soares, J. A.; Ferguson, T. K.; Gallucci, J; Krzycki, J. A.; Chan, M. K. (September 2004). Reactivity and chemical synthesis of L-pyrrolysine- the 22(nd) genetically encoded amino acid. Chemistry & biology 11 (9). с. 1317–24. PMID 15380192. doi:10.1016/j.chembiol.2004.07.011.
- Li, W. T.; Mahapatra, A; Longstaff, D. G.; Bechtel, J; Zhao, G; Kang, P. T.; Chan, M. K.; Krzycki, J. A. (January 2009). Specificity of pyrrolysyl-tRNA synthetase for pyrrolysine and pyrrolysine analogs. Journal of molecular biology 385 (4). с. 1156–64. PMID 19063902. doi:10.1016/j.jmb.2008.11.032.