Регуляція експресії генів
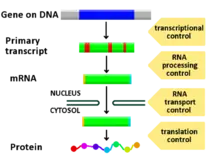
Під регуляцією експресії генів мається на увазі складна сукупність молекулярних механізмів, завдяки яким клітини можуть збільшувати або зменшувати кількість продуктів експресії певних генів (РНК або білків) у відповідь на зміну зовнішніх умов і факторів. Регуляція експресії дозволяє існування різних фенотипів у клітин, що мають ідентичні геноми; це своєю чергою обумовлює гнучкість живих систем та можливість пристосування до зміни факторів середовища. Регуляція експресії генів відіграє ключову роль у таких біологічних явищах, як, наприклад, адаптація бактерій до нового середовища з альтернативним набором поживних речовин. Інформація, закодована в генах транскрибується в РНК, яка після відповідного процесингу транслюється на рибосомі у поліпептидний продукт (білок). Загалом, будь-яка з ланок цього процесу може бути регульована; тому прийнято розрізняти регуляцію генів на рівні транскрипції, регуляцію генів на рівні трансляції тощо.
Ключовою подією у дослідженні регуляції експресії генів стало відкриття лактозного оперону (lac оперону) в 1961 році Жаком Моно. Було показано, що група ензимів, які необхідні для метаболізму лактози, експресуються в бактеріях E. coli тільки в присутності лактози і відсутності основного джерела енергії — глюкози. Тобто на прикладі лактозного оперону було показано, як організми пристосовуються до несприятливих умов середовища, змінюючи набір генів, що експресуються в організмі в певний момент часу.
В багатоклітинних організмах, завдяки регуляції експресії генів відбуваються такі складні явища, як клітинна диференціація та морфогенез. Як правило, ініціатором змін в експресії генів є активація певних рецепторів.
Регуляція на різних рівнях
Кожен з етапів на шляху експресії генів може бути певним чином врегульований, від транскрипції ДНК до посттрансляційного етапу. Далі наведений список ключових рівнів регуляції. Слід зазначити, що з-поміж них найбільш активно регульованим рівнем є транскрипційний.
- Організація та ремоделювання хроматину
- Транскрипція
- Транспорт, процесинг та деградація мРНК
- Трансляція
- Посттрансляційні модифікації
Регуляція на рівні хроматину
В еукаріотах, доступ факторів транскрипції та РНК-полімераз до ДНК залежить від локальної структури хроматину, яка своєю чергою може бути змінена метилюванням ДНК, некодуючими РНК а також ДНК-взаємодіючими білками. Ці фактори поодинці, а також в поєднанні здатні зменшити експресію генів.
Структурна регуляція
Як правило, ступінь спакованості (конденсації) певних ділянок хроматину впливає на рівень експресії генів, які в них розташовані. Розрізняють еухроматин (розконденсовані ділянки з великою інтенсивністю транскрипції) та гетерохроматин (сконденсовані ділянки з низькою інтенсивністю транскрипції генів). Пакування ДНК у вигляді комплексів з гістонами у нуклеосоми можуть становити перешкоду для транскрипції генів. Тому важливу роль у процесі регуляції експресів генів на рівні хроматину відіграють системи ремоделювання хроматину.
Хімічна регуляція
Метилювання ДНК часто спричиняє припинення експресії збережених в ній генів. Метилювання ДНК відбувається за участю метилтрансфераз, які в першу чергу метилюють залишки цитозину в динуклеотидних мотивах СpG (як також називаються «CpG острівцями» у випадку коли вони скупчені у вигляді кластерів). Аномальні профілі метилювання ДНК часто виникають в процесі онкогенезу.[1]
Важливу роль в регулюванні експресії на рівні хроматину грає ацетилювання гістонів. Гістон-ацетилтрансферази (HATs) сприяють дисоціації ДНК з нуклеосом, полегшуючи транскрипцію.
Регуляція на рівні транскрипції
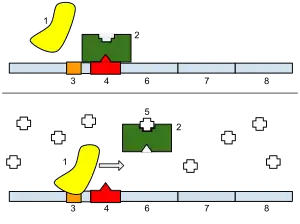
Регуляція транскрипції визначає скільки мРНК буде синтезовано з певного гену. Транскрипція може регулюватись як мінімум п'ятьма різними механізмами.
- Фактори специфічності — це спеціальні білки, які направляють РНК-полімеразу до певних промоторів, підвищуючи рівень експресії таких генів. Прикладом факторів специфічності є сігма-фактори в бактеріях.
- Репресори регулюють експресію генів через зв'язування зі спеціальними контрольними ділянками ДНК, так званими операторами. Репресори унеможливлюють ініціацію транскрипції РНК-полімеразою. Прикладом репресор-залежного контролю експресії генів є лактозний оперон.
- Фактори транскрипції зв'язуються з промоторами певних генів, щоб потім залучити РНК полімеразу до їх транскрипції.
- Активатори підвищують спорідненість між РНК-полімеразою і промоторами певних генів, активуючи їх експресію. Вони можуть робити це напряму або опосередковано, змінюючи локальну структуру ДНК.
- Енхансери — це ділянки ДНК, які зв'язуються з активаторами. Енхансери набагато більш поширені серед еукаріот, ніж серед бактерій.[2]
- Сайленсери — це ділянки ДНК, які, зв'язуючись з певними факторами транскрипції, можуть виключати експресію генів.
Пост-транскрипційна регуляція
Після того як ДНК була транскрибована в мРНК, ці молекули також є мішенню багатьох регуляційних механізмів які можуть підсилювати або пригнічувати трансляцію білків за їх участю. В клітинах це всі процеси, які передують трансляції мРНК, а саме кепування, сплайсинг та поліаденилювання а також транспорт мРНК до місця трансляції.
Регуляція на рівні трансляції
Трансляція мРНК в білок також може бути контрольована багатьма способами, головним чином на рівні ініціації трансляції. Зв'язування мРНК з малою рибосомною субодиницею може бути регульоване вторинною структурою мРНК, наявністю антисенсних послідовностей, РНК-споріднених білків, або комбінацією цих способів. Існує велика кількість прокаріотичних та еукаріотичних РНК-зв'язуючих білків, які часто мають властивість специфічно зв'язуватись з певними вторинними структурами в транскрипті; це в свою чергу перешкоджає асоціації мРНК з рибособними субодиницями, і блокує початок трансляції. Деякі транскрипти, такі як наприклад рибозими, здатні самі контролювати трансляцію самих себе.
Приклади регуляції експресії генів
- Багато низькомолекулярних сполук здатні ініціювати експресію генів які необхідні для їх метаболізму (переробки)
- Індукція експресії протеїнів теплового шоку (heat shock proteins) в Drosophila melanogaster.
- Віруси, незважаючи на те, що вони мають всього декілька генів, мають вбудовані механізми для регуляції їх експресії. Прикладом є регуляція лізогенної/літичної форм бактеріофага лямбда.
- GAL4 є транскрипційним активатором який контролює експресію генів GAL1, GAL7, and GAL10 які кодують ферменти необхідні для метаболізму галактози в дріжджах. Система GAL4/UAS були використана в багатьох інших організмах для вивчення регуляції експресії генів.[3]
Біологія розвитку
Вивчення регуляції експресії генів відіграє велику роль в біології розвитку. Наприклад:
* Детермінування статі у Drosophila потребує визначення відношення аутосомних генів до генів розташованих в статевих хромосомах; результатом є контрольована експресія стать-залежних генів, при чому регуляція відбувається на рівні трансляції .[4]
Методи вивчення
Як правило, більшість експериментів по вивченню різниці в рівні експресії певних генів базуються на екстрагуванні та вивченні клітинних мРНК з клітинної культури або цілого організму. Після цього відносний рівень кожної окремої мРНК може бути визначений за допомогою кількісної ПЦР або ДНК-мікромасивів.
Існують інші методи, які дають змогу вивчити окремо кожну стадію регуляції:
- Локальна структура хроматину та визначення генів, які експресуються в даний момент, може бути досліджена з використанням методів імонуосадження хроматину з антитілами до РНК полімерази II, модифікованих гістонів H3 або інших маркерів транскрипції, антитіла до яких є доступними.
- Епістатичні взаємодії можуть бути дослідженими з використанням аналізу синтетичних генетичних масивів
- Через пост-транскрпційний рівень регуляції, концентрація певної мРНК може бути дуже низькою незважаючи на високу інтенсивність транскрипції. Для вивчення актуального рівня транскрипції доступні методи, що базуються на тіольному міченні.[5]
- Майже вся РНК in vivo існує у вигляді комплексів з регулюючими білками, утворюючи так звані рибонуклеопротеїни. Білкові та нуклеїнові компоненти рибонуклеопротеїнів можуть бути проаналізовані відповідними методами, такими як RIP-Chip. Наприклад, аналіз рибосом-зв'язаних мРНК та рибонуклеопротеїнів дасть уявлення про те які саме гени транслюються в даний момент часу.
- Проетеом клітини, тобто кінцевий вихід контрольованою системи біосинтезу білка, може бути проаналізований методами мас-спектрометрії.
Посилання
- Vertino PM, Spillare EA, Harris CC, Baylin SB (Apr 1993). Altered chromosomal methylation patterns accompany oncogene-induced transformation of human bronchial epithelial cells. Cancer Research 53 (7). с. 1684–9. PMID 8453642.
- Austin S, Dixon R (Jun 1992). The prokaryotic enhancer binding protein NTRC has an ATPase activity which is phosphorylation and DNA dependent. The EMBO Journal 11 (6). с. 2219–28. PMC 556689. PMID 1534752.
- Barnett, J. A. (2004), A history of research on yeasts 7: enzymic adaptation and regulation.
- Gilbert SF (2003).
- Cheadle C, Fan J, Cho-Chung YS, Werner T, Ray J, Do L, Gorospe M, Becker KG (2005). Control of gene expression during T cell activation: alternate regulation of mRNA transcription and mRNA stability. BMC Genomics 6. с. 75. PMC 1156890. PMID 15907206. doi:10.1186/1471-2164-6-75.