Родина білків Bcl-2
Родина білків Bcl-2 — це група еволюційно споріднених білків, що беруть участь у регуляції апоптозу, головним чином шляхом контролювання пермеабілізації зовнішньої мембрани мітохондрій і вивільнення із міжмембранного простору цитохрому c та інших білків у цитозоль. Серед них є як анти-, так і проапоптичні модулятори, які безпосередньо взаємодіють між собою, пригнічуючи одне одного. Баланс активності цих двох груп білків родини Bcl-2 визначає, чи загине клітина шляхом апоптозу.
Класифікація білків родини Bcl-2
В межах родини Bcl-2 розрізняють три класи білків, що різняться за структурою і функціями: антиапоптичні BH1—4 білки («охоронці»), що містять чотири різні домени гомології Bcl-2 (англ. Bcl2 homology (BH) domains), проапоптичні BH123 білки, до складу яких входять три домени гомології («ефектори»), і проапоптичні «тільки BH3» білки, які мають лише BH3 домен («сенсори»)[1].
BH1—4 білки
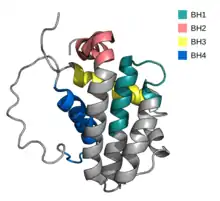
У клітинах ссавців є принаймні п'ять різних антиапоптичних білків родини Bcl-2, зокрема Bcl-2, а також Bcl-XL, діють як «охоронці», тобто запобігають загибелі клітини. Наявність принаймні одного із цих білків є необхідною умовою виживання, а їх інактивація потрібна для запуску внутрішнього шляху апоптозу. Вони локалізуються переважно на цитоплазматичній стороні зовнішньої мембрани мітохондрії, на мембранах ендоплазматичного ретикулуму і ядерної оболонки. Основна функція цих білків полягає у пригніченні проапоптичних білків BH123, таким чином вони допомагають підтримувати цілісність мембран і не допускати виходу білків міжмембранного простору мітохондрій та іонів кальцію з ендоплазматичного ретикулуму в цитозоль[2].
BH123 білки
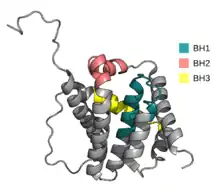
Проапоптичні білки BH123 є безпосередніми виконавцями запуску внутрішнього шляху апоптозу, тому їх називають «ефекторами», саме вони забезпечують утворення пор у зовнішній мембрані мітохондій. Головними представниками цього класу у клітинах ссавців є BAX і BAK1. Перший із них за нормальних умов локалізується у цитоплазмі, а у відповідь на стресовий сигнал, що індукує апоптоз, переміщується на відповідні мебмрани, тоді як другий постійно розміщений на цих мембранах. Внутрішній (мітохондріальний) шлях апоптозу розпочинається із олігомеризації Bax і Bak у внутрішній мембрані мітохондрій, внаслідок чого утворюються пори, через які у цитоплазму можуть проникати білки міжмембранного простору, такий же процес може відбуватись на мембрані ендоплазматичного ретикулумі, звідки виходитимуть іони кальцію[1].
Тільки BH3 білки
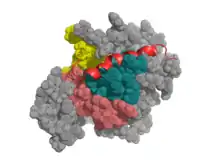
Проапоптичні тільки BH3 білки — найбільший клас у родині Bcl-2, виконують роль сенсорів. У відповідь на апоптичні сигнали вони синтезуються de novo або активуються, після чого працюють в основному як інгібітори антиапоптичних BH1—4 білків. Їхній BH3 домен входить у довгий гідрофобний жолоб BH1—4 білків, внаслідок чого вони втрачають свою активність, а це у свою чергу призводить до вивільнення BH123 білків від їхнього пригнічення. Деякі тільки BH3 білки можуть безпосередньо взаємодіяти із Bax і Bak, сприяючи їх олігомеризації[3].
Білки, що містять тільки BH3 домен є прямою зв'язувальною ланкою між апоптичними сигналами та власне запуском внутрішнього шляху аопоптозу. Наприклад, за браку позаклітинних сигналів виживання MAP-кіназа JNK забезпечує активацію експресії тільи BH3 білка Bim, сигнальний шлях p53, який спрацьовує зокрема під час ушкоджень ДНК, може призвести до збільшення рівня білків Puma і Noxa цього класу[3].
Також тільки BH3 білки забезпечують зв'язок між зовнішнім та внутрішнім шляхами апопотозу. Так ініціаторна каспаза-8, що активуються внаслідок дії на рецептори смерті їхніх лігандів, розрізає Bid, перетворюючи його у вкорочену форму tBid, яка здатна до пригнічення антиапоптичних Bcl-2 білків[4].
Найсильнішими із тільки BH3 білків є Bim, Bid і Puma, вони можуть інгібувати всі антиапоптичні BH1—4 білки, тоді як дія інших обмежуються тільки окремими представниками[4].
Примітки
- Alberts et al, 2007, с. 1122.
- Alberts et al, 2007, с. 1122—1123.
- Alberts et al, 2007, с. 1123.
- Alberts et al, 2007, с. 1124.
Джерела
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
