Апоптоз
Апопто́з (від дав.-гр. απόπτωσις — опадання, листопад[2]) — найбільш розповсюджений тип запрограмованої клітинної смерті. Іншими словами — це сукупність клітинних процесів, що призводять до загибелі клітини. На відміну від іншого виду клітинної смерті — некрозу — при апоптозі не відбувається руйнування цитоплазматичної клітинної мембрани і, відповідно, вміст клітини не потрапляє в позаклітинне середовище. Характерною ознакою є фрагментація ДНК у міжнуклеосомальних ділянках специфічною ендонуклеазою — CAD (caspase activated DNase) на фрагменти з розміром, кратним 180–200 нуклеотидам. В результаті апоптозу відбувається утворення апоптичних тілець — мембранних везикул, які містять цілісні органели і фрагменти ядерного хроматину. Ці тільця поглинаються сусідніми клітинами чи макрофагами в результаті фагоцитозу. Оскільки позаклітинний матрикс не уражається клітинними ферментами, навіть при великій кількості апоптозних клітин, запалення не спостерігається.
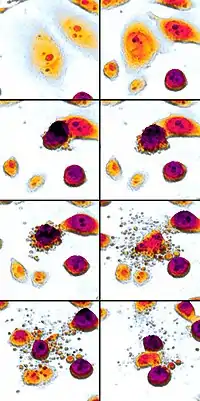
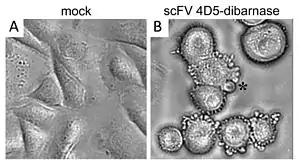
Процес апоптозу є необхідним для фізіологічного регулювання кількості клітин організму, для знищення старих клітин, для формування лімфоцитів, що не є реактивними до своїх антигенів (аутоантигенів), для осіннього опадання листків рослин, для цитотоксичної дії Т-лімфоцитів кіллерів, для ембріонального розвитку організму (зникнення шкірних перетинок між пальцями у ембріонів птахів) та іншого.
Порушення нормального апоптозу клітин призводить до неконтрольованого розмноження клітини і появи пухлини.
Термін «апоптоз» був вперше вжитий 1972 року Керром, Віллі і Керрі, які описали його як доповнювальний, але протилежний до мітозу механізм регуляції популяції тваринних клітин[3].
Значення апоптозу
Апоптоз — невід'ємна частина життєдіяльності більшості багатоклітинних організмів. Особливо важливу роль він відіграє у процесах розвитку. Наприклад кінцівки чотириногих закладаються як лопатоподібні вирости, а формування пальців відбувається завдяки загибелі клітин між ними. Також підлягають апоптозу більше не потрібні клітини, таким чином зокрема руйнується хвіст у пуголовків під час метаморфозу. У нервовій тканині хребетних під час ембріонального розвитку більше половини нейронів гинуть шляхом апоптозу відразу ж після утворення[4].
Також апоптоз є частиною системи контролю за «якістю» клітин, він дозволяє руйнувати ті з них, які неправильно розташовані, ушкоджені, нефункціональні або потенційно небезпечні для організму. Прикладом можуть бути T- та B-лімфоцити, які гинуть, якщо не несуть корисних антиген-специфічних рецепторів або несуть автореактивні. Шляхом апоптозу також помирає більшість лімфоцитів, активованих під час інфекції, після її подолання[4].
У дорослих організмів одночасна регуляція проліферації клітин та апоптозу дозволяє підтримувати сталі розміри цілої особини та її окремих органів. Наприклад, після вживавання препарату фенобарбітал, що стимулює проліферацію гепатоцитів, у пацюків збільшується печінка. Проте, відразу ж після припинення дії цієї речовини всі зайві клітини підлягають апоптозу, внаслідок чого розмір печінки повертається до нормального[5].
Також апоптоз відбувається, коли клітина «відчуває» велику кількість внутрішніх ушкоджень, які вона не може репарувати. Наприклад у разі пошкодження ДНК клітина може трансформуватись у ракову, щоб цього не сталось вона, за нормальних умов, «покінчує життя самогубством». Також гине шляхом апоптозу велика кількість клітин інфікованих вірусами[5].
Маркери апоптичних клітин
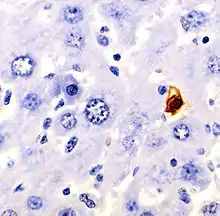
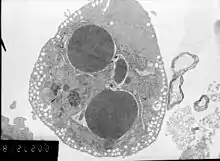
Клітини, що гинуть шляхом апоптозу, можна розпізнати за рядом морфологічних ознак. Вони стають меншими і більш щільними (пікноз), округлюються та втрачають псевдоподії, в них руйнується цитоскелет, розпадається ядерна мембрана, хроматин конденсується і фрагментується. На поверхні клітин з'являється велика кількість пухирців, якщо клітини достатньо великі, то вони розпадаються на оточені мембранами фрагменти — апоптичні тільця[7][8].
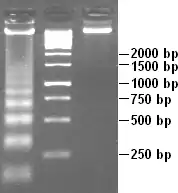
В апоптичних клітинах крім морфологічних відбувається також велика кількість біохімічних змін. Зокрема ДНК розрізається спеціальними нуклеазами у лінкерних ділянках між нуклеосомами на фрагменти рівної довжини. Тому при розділенні всієї ДНК апоптичної клітини за допомогою електрофорезу можна спостерігати характерну «драбинку». Інший метод виявлення фрагментації ДНК — мічення її вільних кінців за допомогою методу TUNEL (Terminal deoxynucleotidyl transferase dUTP nick end labeling)[5].
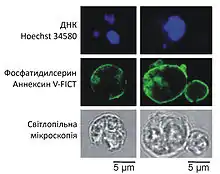
Змін зазнає також і плазматична мембрана апоптичних клітин. За нормальних умов негативно заряджений фосфоліпід фосфатидилсерин міститься тільки в її внутрішньому (повернутому до цитозолю) шарі, проте під час апоптозу він «перескакує» у зовнішній листок. Ця молекула слугує сигналом «з'їж мене» для ближніх фагоцитів. Фосфатидилсерин-індуковане поглинання апоптичних клітин, на відміну від інших типів фагоцитозу, не призводить до виділення медіаторів запалення. Описана зміна плазмалеми лежить в основі ще одного методу виявлення клітин, що гинуть шляхом апоптозу — фарбування анексином V, що специфічно зв'язується із фосфатидилсерином[5].
Під час загибелі клітин шляхом апоптозу вони також втрачають електричний потенціал, що за нормальних умов існує на внутрішніх мембранах мітохондрій. Це явище можна використати для виявлення апоптичних клітин за допомогою позитивно заряджених флуоресцентних барвників, що в нормі накопичуються всередині мітохондрій завдяки негативному заряду на внутрішній поверхні їхніх внутрішніх мембран. Під час апоптозу рівень зафарбовування мітохондрій суттєво знижується. Маркером апоптозу також слугує вивільнення цитохрому c із мітохондрій у цитозоль[9].
Каспази — медіатори апоптозу
Клітинні системи, що забезпечують проходження апоптозу, аналогічні у всіх тварин, центральне місце в них займає родина білків каспаз. Каспази — це протеази, що мають в активному центрі залишок цистеїну, і розрізають свої субстрати по специфічному залишку аспарагінової кислоти (звідси назва: c від cysteine і asp від aspartic acid). Каспази синтезуються в клітині у вигляді неактивних прокаспаз, які можуть ставати субстратами для інших, вже активованих каспаз, що ріжуть їх в одному або двох місцях по залишку аспартату. Два утворені фрагменти — більший і менший — з'єднуються між собою, формуючи димер, що асоціює із таким самим димером. Сформований таким чином тетрамер і є активною протеазою, що може розрізати білки-субстрати. Крім ділянок, що відповідають більшій і меншій субодиницям, прокаспази інколи також містять інгібіторні продомени, які деградують після відщеплення[9].
Внаслідок розщеплення й активації одних каспаз іншими формується протеалітичний каскад, який суттєво посилює сигнал і робить апоптоз із певного моменту незворотним процесом. Ті прокаспази, які розпочинають цей каскад називаються ініціаторними, а їхні сусбтрати — ефекторними. Після аткивації ефекторні каспази можуть розщеплювати інші ефекторні прокаспази або білки-мішені. До мішеней ефекторних каспаз, що руйнуються під час апоптозу належать зокрема білки ядерної ламіни, розщелення яких призводить до розпаду цієї структури. Також деградує білок, що за нормальних умов пригнічує ендонуклеазу CAD, внаслідок цього розпочинається фрагментація ДНК. Розщеплюються каспазами і білки цитоскелету та міжклітинної адгезії, внаслідок чого апоптичні клітини округлюються і від'єднуються від сусідніх клітин, і таким чином стають легшою мішенню для фагоцитів[10].
Набір каспаз, необхідний для проходження апоптозу залежить від типу тканини і шляху, за яким активується клітинна смерть. Наприклад у мишей при «вимкненні» гену, що кодує ефекторну каспазу-3, апоптоз не відбувається у мозку, проте нормально протікає в інших тканинах[10].
Гени прокаспаз активні у здорових клітинах, а отже білки необхідні для протікання апоптозу постійно наявні, потрібна лише їх активація для запуску клітинного суїциду. До складу ініціаторних прокаспаз входить довгий продомен, що містить CARD (caspase recruitment domain, домен залучення каспаз). CARD дає змогу ініціаторним прокаспазам приєднуватись до адаптерних білків утворюючи активаційні комплекси, коли клітина отримує сигнал, що стимулює апоптоз. В активаційних комплексах кілька молекул прокаспаз опиняються безпосередньо поблизу одна одної, чого достатньо для їх переходу в активний стан, після чого вони розрізають одна одну[10].
Два найкраще вивчені сигнальні шляхи активації каскаду каспаз у клітинах ссавців називаються зовнішній і внутрішній (мітохондріальний), кожен із них використовує власні ініціаторні прокаспази[10].
Шляхи активації апоптозу
Зовнішній шлях
Клітина може отримувати сигнал, що індукує апоптоз, іззовні, наприклад, від цитотоксичних лімфоцитів. В такому разі активується так званий зовнішній шлях (extrinsic pathway), що починається із рецепторів смерті. Рецептори смерті — це трансмембранні білки, що належать до родини рецепторів фактора некрозу пухлин (ФНП), наприклад сам рецептор ФНП і рецептор смерті Fas. Вони формують гомотримери, в яких кожен мономер має позаклітинний ліганд-зв'язувальний домен, трансмембранний домен і цитоплазматичний домен смерті, що через адаптерні білки залучає та активує прокаспази[11].
Ліганди рецепторів смерті також є гомотримерами. Вони споріднені між собою і належать до родини сигнальних молекул фактора некрозу пухлин. Наприклад, цитотоксичні лімфоцити несуть на своїй поверхні ліганди Fas, що можуть приєднуватись до рецепторів смерті Fas на плазмалемі клітин-мішеней. В такому разі внутрішньоклітинні домени цих рецепторів з'єднуються із адаптерними білками (FADD, Fas-associated death domain), а ті у свою чергу залучають ініціаторні прокаспази 8 і/або 10. Внаслідок цієї серії подій формується сигнальний комплекс, що індукує смерть, — DISC (death inducing signaling complex). Після активації в цьому комплексі ініціаторні каспази розрізають ефекторні прокаспази і запускають апоптичний каскад[11].
Багато клітин синтезують молекули, що у певній мірі захищають їх від активації зовнішнього шляху апоптозу. Прикладом такого захисту може бути експресія так званих рецепторів-приманок (decoy receptors), що мають позаклітинні домени зв'язування лігандів, проте не мають цитоплазматичних доменів сметрі, а отже не можуть запускати апоптозу і конкурують зі звичайними рецепторами смерті за ліганди. Клітини також можуть продукувати білки, що блокують зовнішній шлях апоптозу, наприклад FLIP, що схожий за структурою до прокаспаз 8 і 10, проте не має протеалітичної активності. Він пригнічує зв'язування ініціаторних прокаспаз із комплексом DISC[11].
Внутрішній шлях
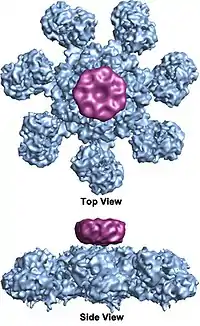
Апоптоз також може запускатись ізсередини клітини, наприклад у випадку її травмування, пошкодження ДНК, нестачі кисню, поживних речовин або позаклітинних сигналів виживання. У хребетних цей сигнальний шлях називається внутрішнім (intrinsic pathway) або мітохондріальним, ключовою подією в ньому є вивільнення певних молекул із міжмембранного простору мітохондрій. До таких молекул зокрема належить цитохром c, що за звичайних умов входить до електрон-транспортного ланцюга мітохондрій. Цитохром c синтезується мітохондрією та виходить з неї завдяки формуванню мітохондріального апоптоз-індукуючого каналу (МАК)[12] та виконує регуляторну роль до настання морфологічних змін, пов’язаних з апоптозом. Після виходу цитохрому с, відбувається його зв’язування з адаптерним білком APAF1 (apoptotic protease actiuating factor-l), викликаючи олігомеризацію останнього у колесоподібну семичленну структуру, що називається апоптосомою. Апоптосома залучає і активує ініціаторну прокаспазу-9, яка після цього може активувати ініціаторні прокаспази[13].
У деяких клітинах зовнішній шлях апоптозу повинен активувати внутрішній для того щоб ефективно знищити клітину. Внутрішній шлях суворо регулюється білками родини Bcl-2[13].
Регуляція внутрішнього шляху білками родини Bcl-2
До родини Bcl-2 належать еволюційно консервативні білки, головною функцією яких є регуляція вивільнення цитохрому c та інших молекул із міжмебранного простору мітохондрій. Серед них є про-апоптичні та анти-апоптичні молекули, які можуть взаємодіяти між собою у різних комбінаціях, пригнічуючи одне одного, баланс між їхньої активністю і визначатиме долю клітини[14].
Зараз відомо близько 20 білків із цієї родини, всі вони містять хоча б один із чотирьох альфа-спіральних доменів гомології Bcl2, що звуться BH1—4 (bcl2 homology). Антиапоптичні білки родини Bcl2 містять всі чотири домени, до них належить сам BCL2, а також Bcl-XL, Bcl-w, Mcl-1 та BCL2A1. Проапоптичні білки діляться на дві групи, члени першої із яких містять три BH-домени (BH1—3), це зокрема BAK, BAX і BOK (останній експресується тільки у тканинах репродуктивних органів). Найбільш численною серед родини Bcl-2 є друга група проапоптичних білків, які містять тільки домен BH3 (BH3-only), до неї належать Bim, BID, BAD, Bik/Nbk, BMF, Nix/BNIP3, Hrk, Noxa, Puma[15].
За нормальних умов (тобто, коли клітина не проходить апоптозу) антиапоптичні білки, такі як Bcl-2 і Bcl-XL, зв'язуються із проапоптичними білками BH123 (Bax і Bak) і не дозволяють їм полімеризуватись у зовнішній мембрані мітохондрій утворюючи пори. Внаслідок дії певного апоптичного стимулу в клітині активуються або починають синтезуватись проапоптичні білки, що містять тільки домен BH3. Вони у свою чергу інгібують антиапоптичні білки, знімаючи їх пригнічувальний ефект на Bak і Bax, або напряму взаємодіють із останніми і сприяють їх олігомеризації та утворенню пор. Внаслідок пермеабілізації зовнішньої мембрани у цитозоль потрапляє цитохром c[14], а також інші медіатори апоптозу, такі як AIF (англ. apoptosis inducing factor).
Наприклад, за браку сигналів виживання у клітині за посередництва MAP-кінази JNK активується експресія BH3 білка Bim, що запускає внутрішній шлях апоптозу. У разі ушкодження ДНК відбувається накопичення супресора пухлин p53, який стимулює транскрипцію генів, що кодують BH3 білки Puma і Noxa, які також забезпечують проходження апоптозу. Ще один BH3 білок — Bid забезпечує зв'язок між зовнішнім та внутрішнім шляхами апоптозу. Після активації рецепторів смерті і, як наслідок, каспази-8, остання розрізає Bid з утворенням усіченої форми tBid (truncated Bid), яка переміщується до мітохонрій, де пригнічує Bcl-2[16].
Примітки
- Edelweiss E, Balandin TG, Ivanova JL, Lutsenko GV, Leonova OG, Popenko VI, Sapozhnikov AM, Deyev SM (2008). Barnase as a new therapeutic agent triggering apoptosis in human cancer cells. PLoS One 18. PMID 18560598. doi:10.1371/journal.pone.0002434.
- Jorge Eduardo Duque-Parra (March 2005). Note on the origin and history of the term "apoptosis". Anatomical record. Part B, New anatomist 283 (1): 2–4. PMID 15761829. doi:10.1002/ar.b.20047.
- Kerr JF, Wyllie AH, Currie AR (1972). Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer 26 (4): 239—57. PMID 4561027.
- Alberts et al, 2007, с. 1116.
- Alberts et al, 2007, с. 1117.
- Stepanek O, Brdicka T, Angelisova P, Horvath O, Spicka J, et al. (2011). Interaction of Late Apoptotic and Necrotic Cells with Vitronectin. PLoS One 4. PMID 21573223. doi:10.1371/journal.pone.0019243.
- Alberts et al, 2007, с. 1115.
- Kroemer G, Galluzzi L, et al (2009). Classification of cell death: recommendations of the Nomenclature Committee on Cell Death 2009. Cell Death Differ 16: 3–11. PMID 18846107.
- Alberts et al, 2007, с. 1118.
- Alberts et al, 2007, с. 1119.
- Alberts et al, 2007, с. 1120.
- Laurent M. Dejean, Sonia Martinez-Caballero, Kathleen W. Kinnally (2006). Is MAC the knife that cuts cytochrome c from mitochondria during apoptosis?. Cell Death and Differentiation 13 (8): 1387–5. PMID 16676005. doi:10.1038/sj.cdd.4401949.
- Alberts et al, 2007, с. 1121.
- Alberts et al, 2007, с. 1122.
- Szegezdi E, Macdonald DC, Ní Chonghaile T, Gupta S, Samali A (2009). Bcl-2 family on guard at the ER. Am J Physiol Cell Physiol 296: C941—53. PMID 19279228. doi:10.1152/ajpcell.00612.
- Alberts et al, 2007, с. 1123—1124.
Посилання
- Apoptosis. YouTube (англ.). GarlandSience. 2009. Процитовано 29 липня 2013.
- Апоптоз (Запрограмована смерть клітини) — Віртуальна бібліотека Біохімії та Клітинної Біології (англійською мовою)
- Портал дослідження (англійською мовою)
- Апоптоз: Інформація (протоколи, статті, новини, останні повідомлення; англійською мовою)
Джерела
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
- АПОПТОЗ Фармацевтична енциклопедія
- АПОПТОЗ ЕСУ
