Руденіт
Руденіт (англ. Rudenite, рос. Руденит) — надщільна алотропна форма вуглецю з двошаровою алмазоподібною структурою

Історія
Новий надщільний двошаровий алмазоподібний вуглецевий алотроп вперше був представлений українськими та російськими вченими на конференції по карбону (Троицк, РФ) в 2015 році [1]. Існування цього унікального матеріалу в 2018 році було підтверджене незалежною групою американських, французьких та італійських вчених [2]. Після ретельного вивчення властивостей та структури цього вуглецевого алотропу було запропоновано надати йому назву руденіт на честь професора А. Д. Рудя [3]
Опис
Вуглець має Алотропи, різні структурні модифікації одного хімічного елемента. Алотропи мають різні фізичні та хімічні властивості. Одним з алотропів вуглецю є руденіт. Руденіт, надщільна вуглецева плівка товщиною 100 пікометрів яку утворюють дві алмазоподібні площини гексагональної структури. На фото a наведено пряме пікоскопічне зображення руденіту [3], вид з боку, отримане шляхом денситометрії електронної хмарки з роздільною здатністю 10 пікометрів. Внутрішні (не валентні) вкладені одна в одну електронні орбіталі з великою густиною електронних хмарок – це кулі білого кольору. Кожен з чотирьох валентних електронів створює ковалентні сігма-зв'язки sp3 гібридізації, як у структурі алмазу: три – в площині (зелений колір) та один – між площинами (блакитний колір). Відповідно до масштабної лінійки, відстань між площинами складає 100 пікометрів. Простір між двошаровими структурами має чорний колір через нульову густину електронної хмарки. Для порівняння на фото b наведено зображення шарів кристалічного графіту [4] вид з боку. Атоми вуглецю мають рожевий колір, що відповідає великій густини електронної хмарки в центрі атома. Сусідні атоми вуглецю в площині шару пов'язують сігма-зв'язки, що утворені в результаті перекриття sp2-орбіталей, на зображенні мають зелений колір. Відповідно до масштабної лінійки, атоми в площині розташовані на відстані біля 140 пікометрів. Відстань між шарами складає 340 пікометрів. Простір між шарами в основному має чорний колір, - електронна хмара відсутня. Але від кожного атома вуглецю, в той чи інший бік, тягнеться пелюсток слабкого пі- зв'язоку, який пов'язує один шар з іншим. На фото ясно видно, що, на відміну від руденіту, в графіті міжшарові зв'язки не є гібридними, бо вони тягнуться від одного атома, але до іншого не доходять. Руденіт, надщільна плівка з двох шарів плоского гексагонального графену.
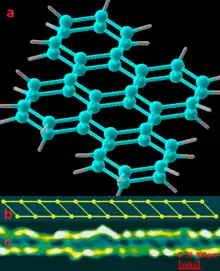
Модель та характеристики
Кристалічна структура руденіту, молекулярного кристала молекул С-С, наведена на малюнку. На малюнку a наведена просторова кульково-сірникова 3D модель руденіту, вид з гори. Два паралельних шара гексагональної структури розташовані на відстані 100 пм. Кожен атом вуглецю створює чотири сильні ковалентні сигма-зв'язки sp3 гібридізації, як у структурі алмазу: три – в площині та один – між площинами. Через надзвичайно малу відстань між молекулами С-С руденіт має щільність у 1,3 рази більшу за алмаз. Для прикладу, найкоротша відстань між двома сусідніми атомами вуглецю в алмазі складає 154 пм, в графіті – 140 пм. Безкоштовна хімічна база даних ChemSpider, від Royal Society of Chemistry, містить відомості про понад 40 мільйонів хімічних сполук, їх властивості та пов’язану з ними інформацію. Унікальність руденіту полягає в тому, що жодна з відомих хімічних сполук не має такої маленької відстані між атомами. Через це руденіт є надщільним ( superdense ) [3] та надтвердим ( ultrahard ) [2] матеріалом у світі.
Потенційне застосування руденіту
Руденіт можна використовувати для екранів захисту від випромінювання і для батарей великої ємності [4]. Розрахунки показують, що конденсатор з руденіту розміром 1 кубічний сантиметр буде мати ємність 8 000 фарад. Він може нести заряд 100 КвЧас що досить, щоб автомобіль Тесла проїхав 500 км.
Алотропні модифікації вуглецю
- Алмаз (sp3-гібридизація)
- Лонсдейліт (sp3-гібридизація)
- Руденіт (sp3-гібридизація)
- Графіт (sp2-гібридизація)
- Аморфний вуглець
- Фулерени, зокрема C60 (sp2-гібридизація) .
- Вуглецеві нанотрубки (sp2-гібридизація)
- Карбін — лінійна форма (sp-гібридизація)
- Графен
Примітки
- Rud, A.D.; Kornienko, N.E.; Kiryan, I.M.; Kirichenko, A.N.; Kucherov, O.P. (2016). Local-allotropic structures of carbon. Thesis "Carbon: the fundamental problems of science, materials science, technology". Troisk.(англ.)
- Gao, Yang; Cao, Tengfei; Cellini, Filippo; Berger, Claire; de Heer, Walter A.; Tosatti, Erio; Riedo, Elisa; Bongiorno, Angelo (2018). Ultrahard carbon film from epitaxial two-layer graphene. Nature Nanotechnology 13: 133–138. doi:10.1038s41565-017-0023-9 (англ.)
- Kucherov, O. P.; Rud, A. D. (2018). Direct visualization of individual molecules in molecular crystals by electron cloud densitometry. Molecular Crystals and Liquid Crystals 674 (1): 40–47. doi:10.1080/15421406.2019.1578510.
- Кучеров А.П., Лавровский С.Е. (2018). Пикоскопия - прямая визуализация молекул. Інформаційні технології та спеціальна безпека ( № 4): 12—41 (рос.).
Джерела
- Глінка М. Л. Загальна хімія : підручник. — 2-ге вид., перероб. і доп. — Київ : Вища школа, 1982. — 608 с.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.