Графіт
Графі́т (від грец. γραφο — писати) — мінерал класу самородних напівметалів, найстійкіший у земній корі кристалічний різновид вуглецю.
| Графіт | |
|---|---|
 | |
| Загальні відомості | |
| Статус IMA | чинний (успадкований, G)[1] |
| Абревіатура | Gr[2] |
| Хімічна формула | С |
| Клас мінералу | самородні напівметали |
| Nickel-Strunz 10 | 1.CB.05a[3] |
| Dana 8 | 1.3.6.2 |
| Генезис | метаморфічний |
| Ідентифікація | |
| Колір | сіро-сталевий, чорний |
| Сингонія | гексагональна |
| Просторова група | кристалографічна група 194d[4] |
| Спайність | досконала |
| Злам | нерівний |
| Твердість | 1 |
| Блиск | металевий |
| Колір риси | чорний |
| Густина | 2,16 ± 0,07 г/см³ |
| Інші характеристики | |
| Названо на честь | писатиd |
| | |
Структура шарувата. Колір чорний, сірий. Сингонія гексагональна. Графіт — темно-сіра непрозора речовина, алотропна форма вуглецю. На відміну від алмазу графіт добре проводить електричний струм і тепло та дуже м'який. Графіт належить до найбільш легкофлотованих мінералів, але його флотованість залежить від величини кристалів, характеру домішок та ступеня окиснення поверхні. Флотацію графіту звичайно проводять з використанням гасу і спінювача у лужному або кислотному середовищі, яке створюється содою, вапном або сірчаною кислотою. Природний аполярний характер кристалів графіту, їхня луската форма і мала густина обумовлюють легку флотованість графіту і дозволяють флотувати досить великі частинки.
Основні характеристики
Домішки: H, N, CO2, CO, CH4, NH3, H2S, H2O. Структура шарувата. Колір чорний, сірий. Сингонія гексагональна. Графіт — темно-сіра непрозора речовина, алотропна форма вуглецю. На відміну від алмазу графіт добре проводить електричний струм і тепло та дуже м'який.
Густина 2,09-2,23. Твердість 1. Блиск металічний, іноді матовий, землистий. Утворюється переважно внаслідок неглибинного метаморфізму гірських порід, що містять органічні рештки, і при контаково-пневматолітових процесах. Графіт утворює лускаті, стовпчасті, масивні, брунькоподібні, сферолітові, циліндричні зональні агрегати. Природний графіт розрізняють за величиною кристалів і їх взаємним розташуванням на явнокристалічний (кристали понад 1 мкм) та прихованокристалічний (менше 1 мкм). У промисловості за величиною кристалів виділяють великокристалічний графіт (понад 50 мкм), дрібнокристалічний (менше 50 мкм) і тонкокристалічний (менше 10 мкм). Графіт жирний на дотик, береться до рук. Анізотропний.
Фізико-хімічні властивості
Як і в алмазі, у графіті кожен атом вуглецю утворює один з одним чотири зв'язки. Однак ці зв'язки не однакові. Три з них є σ-зв'язками, утвореними в результаті перекривання sp2-орбіталей атомів вуглецю. Усі вони розташовуються в одній площині під кутом 120°, утворюючи безперервну плоску сітку, що складається з правильних шестикутників, у кутах яких знаходяться атоми вуглецю. Четвертий -зв'язок утворюється за рахунок перекривання пелюстків р-орбіталей вище і нижче площини, у якій розташовані атоми вуглецю. -зв'язок утворює суцільну електронну хмару по всьому шару атомів вуглецю, як і у випадку металевого зв'язку. Вуглецеві шари графіту пов'язані дуже слабкими силами міжмолекулярної взаємодії. Ці особливості будови графіту й обумовлюють такі його властивості, як електропровідність, шаруватість тощо.
Особливості кристалічної структури графіту та незначна величина сил зчеплення між його шарами зумовлюють ковзання шарів один щодо одного навіть при малих значеннях напруг зсуву в напрямку ковзання. Це дозволяє використовувати вуглеграфітові матеріали як антифрикційні за рахунок низьких сил зчеплення між дотичними поверхнями. З іншого боку, відсутність міцних міжшарових зв'язків у графіті полегшує відділення його частинок від деталей, що труться. Це обумовлює зменшення їх зносу.
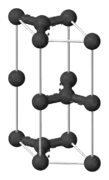 Елементарна комірка графіту
Елементарна комірка графіту Кульково-сірникова модель шару графіту
Кульково-сірникова модель шару графіту Вид збоку
Вид збоку Вид згори
Вид згори СТМ-рисунок атомів на поверхні графіту
СТМ-рисунок атомів на поверхні графіту
Графіт, якщо розглядати його ідеалізовану структуру, являє собою безперервний ряд шарів, рівнобіжних основній площині, що складаються з гексагонально зв'язаних один з одним атомів вуглецю (рис. 1.2). За взаємним зсувом цих шарів у площині розрізняють гексагональну та ромбоедричну форми. У гексагональній формі шари чергуються за схемою А-В-А-В…, а в ромбоедричній — за схемою А-В-С-А-В-С…
Зміщення шарів у ромбоедричній формі може досягати в природних графітах 30 %, у штучних вона практично не зустрічається. Відстань між будь-якими сусідніми атомами вуглецю в площині шару дорівнює 0,1415 нм, між сусідніми шарами — 0,3354 нм.
Така будова приводить до анізотропії фізичних властивостей графіту в напрямках рівнобіжному і перпендикулярному злому.
Описана структура характерна для монокристалічного графіту. Реальні тіла складаються з безлічі областей упорядкованості вуглецевих атомів, що мають кінцеві розміри, які відрізняються на кілька порядків для різних зразків вуглецевих тіл графітової чи графітоподібної структури. Структура цих областей може наближатися до ідеальних ґраток графіту чи відрізнятися від неї за рахунок перекручувань усередині шарів, так і за рахунок порушень їхнього чергування. Такі області упорядкованості називаються кристалітами і мають власні геометричні характеристики: Lа — середній діаметр, Lс — середня висота кристаліта і -середня відстань між шарами графіту у кристаліті. Ці параметри визначаються за допомогою рентгеноструктурного аналізу. Крім того, у реальних графітових тілах є деяка кількість невпорядкованих атомів (аморфний вуглець), що займають простір між кристалітами чи впроваджені між шарами. Ці атоми можуть, знаходиться в sp, sp2 чи sp3 — гібридному стані.
Особливість будови кристалічної ґратки графіту, включаючи наявність в ній вільних електронів, зумовлює його фізичні властивості: низьку твердість, низький коефіцієнт тертя, високу електропровідність, близьку до металів, металевий блиск, непрозорість тощо. Важливе промислове значення мають також висока теплопровідність, вогнестійкість, хімічна твердість, гідрофобність, виключно висока жирність і пластичність, висока здатність утворювати тонкі плівки на твердих поверхнях.
Графіт кристалізується в гексагональній сингонії; його шарувата кристалічна структура характеризується доволі міцним ковалентним гомеополярним зв'язком атомів вуглецю в межах шару, і досить слабким міжшаровим молекулярним зв'язком.
Електропровідність алотропних модифікацій вуглецю дуже відрізняється за абсолютною величиною. Алмаз є діелектриком, причому його електроопір однаковий в усіх напрямках кристала. Це пов'язано з тим, що усі валентні електрони входять у чотири рівноцінні σ-зв'язки, а вільні -електрони, що утворюють хмарку, відсутні.
На відміну від алмазу в монокристалі графіту є σ-зв'язки і -електронні хмарки, що утворюють електронні шари паралельні моношарам вуглецевих атомів і зумовлюють електропровідність металевого типу в напрямку, паралельному шарам. У напрямку їм перпендикулярному графіт поводиться, як напівпровідник, провідність якого визначається позитивно зарядженими дірками. У зв'язку з цим електропровідність графіту в паралельному напрямку приблизно на два-три порядки перевищує провідність у напрямку йому перпендикулярному.
У полікристалічних вуглецевих матеріалах загальна провідність визначається двома складовими: електропровідністю кристалітів, металевою за своїм типом, і провідністю аморфного вуглецю-напівпровідника. Цим обумовлена, екстремальна залежність електропровідності багатьох вуглеграфітових матеріалів від температури: електроопір напівпровідника з ростом температури падає, а металу росте. Тому існує мінімум температурної залежності опору, причому його положення зсувається в область нижчих температур при удосконаленні кристалічної структури зразка. Таким чином, за положенням екстремуму можна судити про ступінь наближення структури до ідеальної графітової.
У монокристалі графіту тепло переноситься, головним чином, уздовж шарів атомів вуглецю, що приводить до анізотропії теплопровідності. Електропровідність і теплопровідність графіту мають різну природу. Остання визначається тепловими коливаннями ґраток монокристала. Коливанню ґраток, яке квантується, ставлять у відповідність рух квазічастинок — фононів. Рух фононів у кристалі подібний до руху молекул ідеального газу в замкнутому об'ємі і підкоряється таким же кінетичним закономірностям. Фононна провідність цілком визначає теплопровідність графіту в напрямку перпендикулярному шарам. У напрямку паралельному шарам перенесення тепла здійснюється і носіями заряду.
Як для ізотропного алмазу, так і для анізотропного графіту температурна залежність теплопровідності має максимум, положення та рівень якого визначається низкою не до кінця з'ясованих факторів, зокрема розміром зразка, величиною й орієнтацією в ньому кристалітів та ін. Положення максимуму теплопровідності природного графіту знаходиться в області Т=120-200 К. Існує встановлений емпіричним шляхом зв'язок між теплопровідністю й електропровідністю графіту. При температурах, близьких до кімнатних, він виражається рівнянням:
- λ•ρ =const,
де ρ — електроопір, λ — теплопровідність.
Класична теорія теплоємності дає її значення для кристалів при досить високих температурах приблизно 25 Дж/(моль•К). У випадку графітів величина теплоємності відповідає теоретичній в температурному інтервалі 2200-3200 К. Потім вона починає рости за експонентним законом. Це зростання пояснюють збільшенням кількості вакансій у кристалічних ґраток, що виникають за рахунок випаровування графіту.
Теплове розширення графіту анізотропне, як і багато його інших фізичних властивостей. Анізотропія характеризується відношенням коефіцієнтів розширення зразка у паралельному і перпендикулярному напрямках зламу. Це відношення для різних графітів знаходиться в межах від 1 до 30.
Графіт та алмаз можуть за певних умов переходити один в одного.
Пряме пікоскопічне зображення графіту

Пряме пікоскопічне зображення монокристалічного графіту[5] (роздільна здатність 10 пікометрів), отримане шляхом денситометрії електронної хмарки [6]. Зображені шари від з боку. Праворуч наведено шкалу густини електронної хмарки в процентах. Атоми вуглецю мають зелений колір, що відповідає великій густини електронної хмарки від 80% і до 100% в ценрі атому. Сусідні атоми вуглецю в площині шару пов'язані сігма-зв'язками, утвореними в результаті перекривання sp2-орбіталей атомів вуглецю на зображенні мають зелений колір, електронна густина 50%. Відповідно до масштабної лінійки, атоми в площіні розташовані на відстані порядка 140 пікометрів. Відстань між шарами складає 340 пікометрів. Простір між шарами в основному має очорний колір, - електронна хмара відсутня. Але від кожного атома вуглецю, в той чи інший бік, тягнется пелюсток р-орбіталі блакитного кольору, електронна густина 20%. Це пі-зв'язок, який утворює електронну хмару пов'язану з одним шаром, але розірвану з іншим. Ця розірваність обумовлює слабку провідність між шарами та ковзання шарів один до одного. Але, як показано на прямому пікоскопічному зображенні в роботі[7], з певних обставин, пелюстки р-орбіталей з сусідніх шарів можуть з'эднуватись. При цьому створюється sp3-орбіталі і графіт перетворюється на алмаз.
Різновиди графіту
Розрізняють:
- графіт аморфний (скупчення графіту, які складаються з рентгеноаморфних агрегатів); Розмір зерен в аморфному графіті менше 0,001 мм.
- графіт землистий (землисті скупчення графіту); В зернистому графіті розмір кристалів той же, що і в дрібнолускатому, однак вони не орієнтовані, що ускладнює розщеплення агрегату та зсуви при деформації.
- графітит (прихованокристалічна форма графіту);
- графіт кристалічний (агрегати графіту, які складаються з кристалічних індивідів);
- графіт лускуватий (агрегати графіту, складені з лускуватих індивідів); Лускаті графіти за діаметром кристалів розподіляються на великолускаті (0,1-1,0 мм) та дрібнолускаті (0,001-0,1 мм).
- графіт марганцевий (вад);
- графіт пластинчастий (агрегати графіту, складені з великолускуватих індивідів);
- графіт пластівчастий (графіт пластинчастий);
- графіт штучний (графіт, одержаний при нагріванні вугілля (антрациту) до 2200—25000С в електричній печі).
- ромбоедричний графіт
- спучений графіт
Визначені природні різновиди графіту не бувають бездоганно чистими. Вони містять домішки мінералів-супутників, а також вуглецю, що не перетворився на графіт.
Графітові руди
Графітові руди залежно від структури графіту підрозділяються на три типи: лускаті, щільнокристалічні та прихованокристалічні.
Найбільшу цінність мають лускаті руди, в яких графіт знаходиться у вигляді окремих кристалів у формі лусок розміром до декількох міліметрів.
Щільнокристалічні руди містять велику кількість (до 60 — 70 %) графіту з розміром лусок менше 0,1 мм, у прихованокристалічних рудах розміри кристалів не перевищують 1 мкм.
Родовища графіту
В Україні
Україна забезпечена запасами графіту, розвідано 5 великих родовищ.
Родовища кристалічного графіту в межах Українського щита утворюють велику графітоносну провінцію, серед якої виділяється чотири графітоносні райони: Бердичівський, Побузький, Криворізький та Приазовський[8].
- Заваллівське родовище графіту
- Петрівське графітове родовище (Петрове (смт))
- Буртинське графітове родовище (Буртин)
- Старокримське родовище графіту (Старий Крим, МарКоГраф)
У світі
Переробка і одержання штучного графіту
Збагачення графітових руд
Графіт належить до найбільш легкофлотованих мінералів, але його флотованість залежить від величини кристалів, характеру домішок та ступеня окиснення поверхні. Флотацію графіту звичайно проводять з використанням гасу (0,2 — 2,5 кг/т) і спінювача (соснової олії, Т-66 і ін.) у лужному (рН = 8 — 10) або кислому (рН = 4 — 5) середовищі, яке створюється содою, вапном або сірчаною кислотою. Природний аполярний характер кристалів графіту, їхня луската форма і мала густина обумовлюють легку флотованість графіту і дозволяють флотувати досить великі частинки.
Одержання штучного графіту
В промисловості графіт одержують:
- нагріванням коксу або антрациту в спеціальних електричних печах при температурі близько 3 000°С і підвищеному тиску без доступу повітря.
- із газоподібних вуглеводнів при температурі 1400—1500° С в вакуумі з подальшим нагріванням утвореного піровуглецю до температури 2500-3000° С під тиском 50 МПа (утворений продукт — пірографіт).
Штучний графіт відзначається високою чистотою і м'якістю. За своїми якостями він кращий за природний.
Штучний графіт за якістю приблизно відповідає природному лускатому і щільнокристалічному, відрізняючись більшою чистотою та меншою кристалічністю.
Застосування
Графіт широко застосовується для виготовлення електродів і нагрівальних елементів, щіток для електродвигунів, струмоприймачів для електротранспорту, підйомно-транспортних машин і потужних реостатів, сповільнювачів нейтронів ядерних реакторів (ядерний графіт), а в суміші з глиною — для виробництва вогнетривких тиглів та футеровочних плит. З графіту роблять прості олівці та виготовляють штучні алмази. В суміші з мінеральною оливою його використовують як мастило для машин, що працюють при підвищених температурах. Графіт також використовується для отримання хімічно активних металів методом електролізу розплавлених сполук (зокрема, при отриманні алюмінію).
Графіт має унікальні властивості покращувати антифрикційні властивості багатьох полімерних матеріалів (фторопласт, поліаміди тощо), які застосовуються як деталі вузлів тертя.
Див. також
Примітки
- Нікель Е. Г., Nichols M. C. IMA/CNMNC List of Mineral Names (March 2007) — 2007.
- Warr L. N. IMA–CNMNC approved mineral symbols // Mineralogical Magazine — Cambridge University Press, 2021. — Vol. 85. — P. 291–320. — ISSN 0026-461X; 1471-8022 — doi:10.1180/MGM.2021.43
- Ralph J., Nikischer T., Hudson Institute of Mineralogy Mindat.org: The Mineral and Locality Database — [Keswick, VA], Coulsdon, Surrey: 2000.
- mineralienatlas.de
- Kucherov O. P. , A. D. Rud A. D. Direct visualization of individual molecules in molecular crystals by electron cloud densitometry // Molecular Crystals and Liquid Crystals. — 2018. — Т. 1, № 10. — С. 40—47. DOI:10.1080/15421406.2019.1578510 (англ.)
- Кучеров А.П., Лавровский С.Е. Пикоскопия - прямая визуализация молекул // Информаційнї технології та спеціальна безпека. — 2018. — № 4. — С. 12—41. (рос.) https://science-ua.com/gallery/maketn2-1.pdf#page=12
- Kucherov O., Rud A., Gubanov V., Biliy M. Spatial 3d Direct Visualization of Atoms, Molecules and Chemical Bonds // American Journal of Applied Chemistry. — 2020. — Т. 8, № 4. — С. 94—99. DOI: 10.11648/j.ajac.20200804.11(англ.)
- Гірничорудні корисні копалини
Література
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Лазаренко Є. К., Винар О. М. Графіт // Мінералогічний словник. — К. : Наукова думка, 1975. — 774 с.
- Графіт // Мінералого-петрографічний словник / Укл. : Білецький В. С., Суярко В. Г., Іщенко Л. В. — Х. : НТУ «ХПІ», 2018. — Т. 1. Мінералогічний словник. — 444 с. — ISBN 978-617-7565-14-6.
- Ф. А. Деркач «Хімія» Л. 1968
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Л.Шпильовий, В.Білецький. Український графіт. // Геотехнології. № 3. — 2020 р. С.14–25.