Електронна хмарка
Електро́нна хма́рка (рос. электpонное облако, англ. electron cloud) — графічне зображення області, де перебування електрона є найімовірнішим. Термін використовується для унаочнення розташування електронів (розподілу електронної густини в просторі) на молекулярних чи атомних орбiталях.
Електронна хмара- електрони, що покинули метал, утримуються біля його поверхні електричним полем,створеним електронною хмарою та нескомпенсованими позитивними йонами металу
Загальний опис
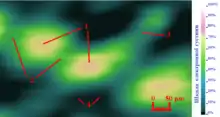
Просторовий розподіл густині електронної хмарки виникає через хвильову природу електрона, він є рішенням рівняння Шредінгера і визначає форму, фізичні та хімічні властивості квантових об’єктів: атомів, молекул та хімічних зв’язків. Електронна хмарка є реальним фізичним об'єктом і її густина вимірюється шляхом денситометрії. На малюнку показані: 1) електроні хмарки окремих атомів вуглецю (жовті); 2) сігма-зв'язки (зелені); 3) Пі-зв'язок (синій); 4) вільний простір (чорний). Праворуч наведено шкалу електронної густини.
Історія
Першу модель атома у вигляді хмарки, інколи її називають Модель атома Томсона (англ. plum pudding model) в 1904 році запропонував Джозеф Джон Томсон. Відкривши у 1897 році електрон, дослідник припустив, що негативно заряджені електрони, входять до складу атома. В 1911 році Ернест Резерфорд внаслідок експерименту з розсіяння альфа-частинок показав, що позитивно заряджена субстанція зосереджена в ядрі, яке принаймні у 3000 разів менше від розміру атома. В 1926 році Ервіном Шредінгером та Вернером Гейзенбергом була розроблена Квантова механіка, яка показала 'наявність' обертального руху легких електронів навколо важкого ядра та ' відсутність ' у електронів орбіт. Електрони заповнюють весь об'єм атома і середовище, де знаходяться електрони, замість позитивно зарядженого "пудінга Томсона" почали називати негативно зарядженою електронною хмаркою. На сьогодні електрона хмарка є загально прийнятою моделлю атома. Вона полягає в тому, що стан електрона в атомі описує густина електронної хмарки 'ρ (x,y,z)', яка визначається як квадрат модуля хвильової функції 'Ψ (q)', яка знаходиться з рівняння Шредінгера. Пряме пікоскопічне зображення електронної хмарки було отримано в 2018 році [О.П. Кучеровим] із співавторами [1], [2], [3] за допомогою денситометра, патент України [№ 115602, від 27.02.2018р]. Виходячи з Квантово механічної теорії хвильову функцію системи 'Ψ(q)' було знайдено з рівняння Шредінгера та принципу суперпозиції. В результаті інтегрування хвильової функції системи 'Ψ(q)' в загальному вигляді було знайдено інтенсивність пучка електронних променів 'I(x,y)' в залежності від густини електронної хмарки 'ρ(x,y)':
'I (x,y) = jnρ(x,y)',
де 'j' - інтенсивність пучка електронних променів; 'n' - кількість електронів у хмарці. Таким чином, інтенсивність пучка електронних промінів на екрані денситометра в точці 'x,y' прямо пропорційна густині електронної хмарки в стовпчику з підставою в точці 'x,y'.
Властивості
Відповідно електронна хмарка є реально існуючим об’єктом. Вона відповідає за молекулярні, атомні орбіталі та їх енергетичні властивості. Виходячи з періодичного закону Д. І. Менделеева форма електронної хмарки визначає властивості атомів вступати в хімічні реакції.
Джерела
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Білий М. У., Охріменко Б. А. Атомна фізика. — К. : Знання, 2009. — 559 с.
- Кучеров А.П., Лавровский С.Е. Пикоскопия - прямая визуализация молекул // Информаційнї технології та спеціальна безпека. — 2018. — № 4. — С. 12—41. (рос.)
- Kucherov O. P. , A. D. Rud A. D. Direct visualization of individual molecules in molecular crystals by electron cloud densitometry // Molecular Crystals and Liquid Crystals. — 2018. — Т. 1, № 10. — С. 40—47. DOI: 10.1080/15421406.2019.1578510 (англ.)
- Kucherov O., Rud A., Gubanov V., Biliy M. Spatial 3d Direct Visualization of Atoms, Molecules and Chemical Bonds // American Journal of Applied Chemistry. — 2020. — Т. 8, № 4. — С. 94—99. DOI: 10.11648/j.ajac.20200804.11 (англ.)
