Сигма-зв'язок
Сигма-зв'язок або σ-зв'язок — різновид ковалентного зв'язку, для якого характерна осьова симетрія. Сигма-зв'язки — найміцніші із ковалентних зв'язків.

Опис
На фото відображений сигма-зв'язкок між двома атомами карбону. Пряме пікоскопічне зображення сигма -зв'язку, отримане шляхом денситометрії електронної хмарки з роздільною здатністю 10 пікометрів. Внутрішні орбіталі – це вкладені одна в одну кулі білого та рожевого кольору. Гібридні орбіталі, що утворюють сигма-зв'язок – це вкладені одна в одну «гантелі» жовтого та зеленого кольору. На периферії можна побачити слабкі (сині) залишки електронної хмарки. Пряме пікоскопічне зображення сигма -зв'язків в графіті та графені[1], та в алмазі[2] .
Прикладами є зв'язки у двоатомних молекулах на зразок H2, N2, O2. Сигма-зв'язки утворюються також між атомами Карбону в хребтах полімерів, причому в насичених полімерах — це єдиний тип зв'язку, у ненасичених полімерах існують ще додаткові пі-зв'язки.
Міцність сигма-зв'язків пояснюється тим, що вони утворюються симетричною комбінацією атомних орбіталей, при якій електронна густина найбільша в області між атомами. Антисиметрична комбінація атомних орбіталей, при якій електронна густина найменша в області між атомами, призводить до відштовхування. Таку молекулярну орбіталь позначають σ* і називають антизв'язком.
Найчастіше основний внесок в утворення сигма-зв'язків роблять s-орбіталі. Іншими кандитами є pz-орбіталі та dz2-орбіталі, тобто орбіталі з квантовим числом m = 0. Утворені з цих орбіталей гібридні орбіталі позначають q-орбіталями.
| σ-зв'язок. Ілюстрація перекриття різних орбіталей | |||
Молекулярна орбіталь H2 |
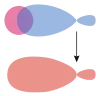 s-q-MO |
 s-p-MO |
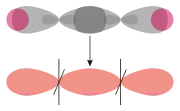 q-q-MO |
Див. також
Посилання
- Визначення σ-зв'язку IUPAC (англ.)
- Kucherov O. P. , A. D. Rud A. D. Direct visualization of individual molecules in molecular crystals by electron cloud densitometry // Molecular Crystals and Liquid Crystals. — 2018. — Т. 1, № 10. — С. 40—47. DOI: 10.1080/15421406.2019.1578510 (англ.)
- Kucherov O., Rud A., Gubanov V., Biliy M. Spatial 3d Direct Visualization of Atoms, Molecules and Chemical Bonds // American Journal of Applied Chemistry. — 2020. — Т. 8, № 4. — С. 94—99. DOI: 10.11648/j.ajac.20200804.11 (англ.)
Література
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
