Сили Ван дер Ваальса
Си́ли Ван дер Ваа́льса[1] — сили міжмолекулярної взаємодії з енергією 0,8—8,16 кДж/моль, загальний термін для позначення сил взаємодії між нейтральними атомами на далекій, у порівнянні з розмірами атомів, відстані.
Загальний опис
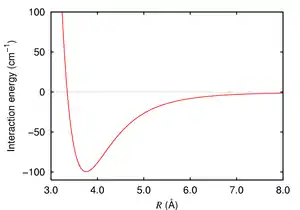
Сили Ван дер Ваальса задаються сферично симетричним потенціалом, обернено пропорційним відстані у шостому степені:
- ,
де a — характерна для конкретних атомів стала, r — відстань між атомами. Знак мінус свідчить про те, що сили Ван дер Ваальса зумовлюють притягання між атомами.
Існують три типи Ван дер Ваальсових сил, причому всі вони мають електромагнітну природу:
- орієнтаційні сили[2],
- дисперсійні (лондоновські) сили[3],
- індукційні сили[4].
У випадку нейтральних атомів без власного дипольного моменту, сили Ван дер Ваальса зумовлені взаємодією наведених дипольних моментів атомів. Заряджене ядро й електрони одного атома поляризують інший атом. Як наслідок, обидва атоми отримують наведений дипольний момент. Взаємодія цих моментів (її часто називають наведеною диполь-дипольною взаємодією, Лондонівською взаємодією[5] або дисперсійною взаємодією) зумовлює притягання між атомами, тобто Ван дер Ваальсові сили. Вона залежить від поляризовності атомів.
У випадку атомів, які мають власний дипольний момент, у Ван дер Ваальсові сили вносять вклад два додаткові ефекти: орієнтаційна взаємодія й поляризаційна взаємодія.
Сили Ван дер Ваальса слабкі в порівнянні з іншими видами електромагнітної взаємодії (енергія ван-дер-ваальсових зв'язків становить 0,1—2,4 ккал/моль, водневих зв'язків — 5—6 ккал/моль, хімічних зв'язків — 50—100 ккал/моль). Проте вони зумовлюють утворення молекулярних кристалів.
Вандерваальсівський зв'язок
Зв'язок, значно слабкіший від звичайних хімічних зв'язків, викликаний силами Ван дер Ваальса: це, зокрема, сили притягання, зумовлені рухом електронів у атомах, напр., утримання графітних шарів, але особливо чітко цей зв'язок може бути описаний у випадку комплексів, утворених атомами інертних газів (енергія зв'язку He–He становить лише 83 Дж моль−1, довжина 289 пм).
Вандерваальсівський комплекс
Молекулярна система, в якій окремі індивідуальні частини утримуються разом за рахунок притягальних сил, основний вклад в які вносять дисперсійні сили. Раніше так називали комплекс, що утворений за рахунок будь-яких сил, інших, ніж у ковалентних зв'язках.
Вандерваальсівський радіус
Половина відстані, на якій між однаковими валентно незв'язаними атомами зрівноважуються сили притягання та відштовхування.
Примітки
- Названі на честь Яна Дидерика Ван дер Ваальса, оскільки відповідають за притягальну частину взаємодії, яка зумовлює зменшення тиску в рівнянні ван дер Ваальса
- Орієнтаційні сили на сайті www.mathcell.ru
- Дисперсійні сили на сайті www.mathcell.ru
- Індукційні сили на сайті www.mathcell.ru
- На честь Фріца Лондона
Джерела
- Білий М.У. (1973). Атомна фізика. Київ: Вища школа.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
