Тромбоксан
Тромбоксан є сполукою сімейства ліпідів, відомих як ейкозаноїди. Двома основними тромбоксанами є тромбоксан А2 і тромбоксан В2. Відмінною рисою тромбоксанів є 6-членне кільце, що містить ефір.
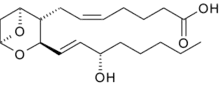
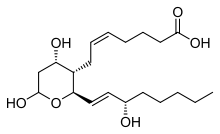
Тромбоксан названий за його роль у формуванні згустків при тромбозі.
Вироблення
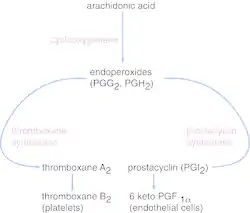
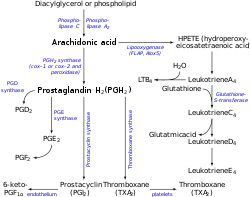
Тромбоксан-А синтаза, фермент, що міститься в тромбоцитах, перетворює похідне арахідонової кислоти простагландин Н2 у тромбоксан.
Вироблення Тромбоксана A2 здійснюється за допомогою послідовного процесу, що починається з арахідонової кислоти (АК). Арахідонова кислота є поліненасиченою жирною кислотою, присутньою у фосфоліпідній мембрані клітин організму. В умовах запалення фосфоліпаза А2 відщеплює арахідонову кислоту від клітинної мембрани та перетворюється на простагландин Н2 (PGH2) під дією ферменту ЦОГ (циклооксигенази). Існують дві еволюційно консервативні ізоформи ЦОГ, включаючи ЦОГ-1 та ЦОГ-2. ЦОГ-1 конститутивно експресується в тромбоцитах, а ЦОГ-2 є формою, що індукується та виявляється тільки в невеликій частині циркулюючих тромбоцитів в нормальних умовах.
Механізм
Тромбоксан діє, зв'язуючись з будь-яким з рецепторів тромбоксану, та рецепторів зв'язування G-білків, пов'язаних з G-білком Gq.[1]
Функції
Тромбоксан — це судинозвужувальний засіб та потужний гіпертонічний засіб, що сприяє агрегації тромбоцитів.
Він знаходиться в гомеостатичному балансі в системі кровообігу із спорідненою сполукою простацикліном. Механізм секреції тромбоксанів з тромбоцитів досі незрозумілий. Вони діють на утворення тромбів і зменшують приплив крові до місця згустку.
Тромбоксан A2 є медіатором позитивного зворотного зв'язку під час активації тромбоцитів. Через короткий період напіввиведення, що становить близько 30 секунд, Тромбоксан A2 діє в аутокринній або паракринній речовині, активуючи сусідні тромбоцити та генеруючи більше Тромбоксану A2 та посилюючи дію інших, більш потужних агоністів тромбоцитів. Коли Тромбоксан A2 зв'язується з TP (рецептор, пов'язаний з G-білком (GPCR), що експресується в різних тканинах і клітинах, включаючи тромбоцити), відбувається активація тромбоцитів, що веде до зміни форми тромбоцитів, активації фосфоліпази A2, дегрануляції щільних та альфа-гранул тромбоцитів та агрегації тромбоцитів. Тромбоксан A2 також викликає вазоконстрикцію гладких м'язів
Роль А2 у агрегації тромбоцитів
Тромбоксан A 2 (TXA 2), що продукується активованими тромбоцитами, має протромботичні властивості, стимулюючи активацію нових тромбоцитів, а також збільшуючи агрегацію тромбоцитів.
Агрегація тромбоцитів досягається посередницькою експресією глікопротеїнового комплексу GP IIb/IIIa в клітинній мембрані тромбоцитів. Циркулюючий фібриноген пов'язує ці рецептори на прилеглих тромбоцитах, додатково зміцнюючи згусток.
Патологія
Вважається, що звуження судин, спричинене тромбоксанами, відіграє певну роль при стенокардії Принцметала. Омега-3 жирні кислоти метаболізуються з утворенням більш високих рівнів TxA 3, який є відносно менш потужним, ніж TxA 2 та PGI 3; отже, відбувається зміщення балансу в бік інгібування звуження судин і агрегації тромбоцитів. Вважається, що цей зсув рівноваги знижує частоту інфаркту міокарда (інфаркт) та інсульту. Звуження судин і, можливо, різні передзапальні ефекти, що здійснюються TxA на мікросудинну тканину, є ймовірною причиною того, що TxA є патогенним при різних захворюваннях, таких як ішемія-реперфузійне ураження,[2] запальні процеси печінки[3], гостра гепатотоксичність[4] тощо. TxB2, стабільний продукт розпаду TxA2, відіграє роль у гострій гепатоксичності, викликаній ацетамінофеном[5][6].
Інгібітори
Інгібітори тромбоксану в цілому поділяють на ті, що пригнічують синтез тромбоксану, та на ті, що пригнічують його цільовий ефект.
Інгібітори синтезу тромбоксану, в свою чергу, можна класифікувати щодо того, який етап синтезу вони інгібують:
- Широко використовуваний препарат аспірин діє, пригнічуючи здатність ферменту ЦОГ синтезувати попередники тромбоксану в тромбоцитах. Тривале застосування низьких доз аспірину незворотно блокує утворення тромбоксану А <sub id="mwVw">2</sub> у тромбоцитах, виробляючи інгібуючий ефект на агрегацію тромбоцитів. Ця антикоагулянтна властивість робить аспірин корисним для зменшення частоти серцевих нападів.[7] 40 мг аспірину на день здатний інгібувати значну частку максимального вивільнення тромбоксану А 2, що провокується гостро, при цьому синтез простагландину І2 мало впливає; однак для досягнення подальшого гальмування необхідні більш високі дози аспірину[8].
- Інгібітори тромбоксансинтази пригнічують кінцевий фермент (тромбоксансинтазу) у синтезі тромбоксану. Іфетробан є потужним та селективним антагоністом рецепторів тромбоксану[9]. Дипіридамол також протидіє цьому рецептору, але також має різні інші механізми антитромбоцитарної активності.
- Високі дози напроксена можуть спричинити майже повне придушення тромбоцитарного тромбоксану протягом усього інтервалу дозування, і, схоже, не збільшують ризик серцево-судинних захворювань (ССЗ), тоді як інші схеми високих доз НПЗП (нестероїдні протизапальні) мають лише тимчасовий вплив на тромбоцити COX-1 і було встановлено, що вони пов'язані «з невеликою, але певною судинною небезпекою»[10].
Інгібіторами цільових ефектів тромбоксану є антагоніст рецепторів тромбоксану, включаючи терутробан.
Пікотамід має активність, і як інгібітор синтезу тромбоксану, і як антагоніст рецепторів тромбоксану[11].
Рідогрель — ще один інгібітор. Також є й інші інгібітори.
Примітки
- Rat kidney thromboxane receptor: molecular cloning, signal …
- Ito Y (2003). Effects of selective cyclooxygenase inhibitors on ischemia/reperfusion-induced hepatic microcirculatory dysfunction in mice. Eur Surg Res 35 (5): 408–16. PMID 12928598. doi:10.1159/000072174.
- Katagiri H (2004). Role of thromboxane derived from COX-1 and -2 in hepatic microcirculatory dysfunction during endotoxemia in mice. Hepatology 39 (1): 139–150. PMID 14752832. doi:10.1002/hep.20000.
- Yokoyama Y (2005). Role of thromboxane in producing hepatic injury during a hepatic stress disorder.. Arch. Surg. 140 (8): 801–7. PMID 16103291. doi:10.1001/archsurg.140.8.801.
- Cavar I (2011). Anti-thromboxane B2 antibodies protect against acetaminophen-induced liver injury in mice. Journal of Xenobiotics 1 (1): 38–44. doi:10.4081/xeno.2011.e8.
- Cavar I (2010). The role of prostaglandin E2 in acute acetaminophen hepatotoxicity in mice. Histol Histopathol 25 (7): 819–830. PMID 20503171.
- American Heart Association: Aspirin in Heart Attack and Stroke Prevention «The American Heart Association recommends aspirin use for patients who've had a myocardial infarction (heart attack), unstable angina, ischemic stroke (caused by blood clot) or transient ischemic attacks (TIAs or „little strokes“), if not contraindicated. This recommendation is based on sound evidence from clinical trials showing that aspirin helps prevent the recurrence of such events as heart attack, hospitalization for recurrent angina, second strokes, etc. (secondary prevention). Studies show aspirin also helps prevent these events from occurring in people at high risk (primary prevention).»
- Tohgi, H; S Konno; K Tamura; B Kimura; K Kawano (1992). Effects of low-to-high doses of aspirin on platelet aggregability and metabolites of thromboxane A2 and prostacyclin. Stroke 23 (10): 1400–1403. PMID 1412574. doi:10.1161/01.STR.23.10.1400.
- Dockens, RC; Santone, KS; Mitroka, JG; Morrison, RA; Jemal, M; Greene, DS; Barbhaiya, RH (Aug 2000). Disposition of radiolabeled ifetroban in rats, dogs, monkeys, and humans.. Drug Metabolism and Disposition 28 (8): 973–80. PMID 10901709.
- Coxib and traditional NSAID Trialists' (CNT) Collaboration (30 травня 2013). Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials. Lancet 382 (9894): 769–79. PMC 3778977. PMID 23726390. doi:10.1016/S0140-6736(13)60900-9.
- Ratti, S; Quarato, P; Casagrande, C; Fumagalli, R; Corsini, A (1998). Picotamide, an antithromboxane agent, inhibits the migration and proliferation of arterial myocytes. European Journal of Pharmacology 355 (1): 77–83. PMID 9754941. doi:10.1016/S0014-2999(98)00467-1.
Література
- Shin, J.-H., Irfan, M., Rhee, M. H., & Kwon, H.-W. (2021). Derrone Inhibits Platelet Aggregation, Granule Secretion, Thromboxane A2 Generation, and Clot Retraction: An In Vitro Study. Evidence-Based Complementary & Alternative Medicine (ECAM), 1–9. https://doi.org/10.1155/2021/8855980