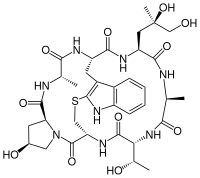
Фалоїдин
Фалоїдин належить до групи токсинів відомих під назвою фалотоксини, які містяться у деяких видах грибів роду Мухомор (Amanita), зокрема в A.phalloides, з якого фалоїдин було вперше ізольовано. Від видової назви цього гриба, власне й походить назва сполуки. Це стійкий біциклічний гептапетид здатний спричинити смерть через кілька днів після ін'єкції до кровотоку.
| Фалоїдин | |
|---|---|
 | |
| Ідентифікатори | |
| Номер CAS | 17466-45-4 |
| PubChem | 441542 |
| Номер EINECS | 241-484-5 |
| KEGG | C08439 |
| Назва MeSH | D04.345.566.735, D12.644.456.735, D12.644.641.735 і D23.946.587.755 |
| ChEBI | 8040 |
| SMILES |
C[C@H]1C(=O)N[C@H]2Cc3c4ccccc4[nH]c3SC[C@H](C(=O)N5C[C@@H](C[C@H]5C(=O)N1)O)NC(=O)[C@H](NC(=O)C(NC(=O)[C@@H](NC2=O)C[C@](C)(CO)O)C)[C@H](C)O |
| InChI |
1/C35H48N8O11S/c1-15-27(47)38-22-10-20-19-7-5-6-8-21(19)41-33(20)55-13-24(34(53)43-12-18(46)9-25(43)31(51)37-15)40-32(52)26(17(3)45)42-28(48)16(2)36-30(50)23(39-29(22)49)11-35(4,54)14-44/h5-8,15-18,22-26,41,44-46,54H,9-14H2,1-4H3,(H,36,50)(H,37,51)(H,38,47)(H,39,49)(H,40,52)(H,42,48)/t15-,16?,17-,18+,22-,23-,24+,25-,26+,35+/m0/s1 |
| Номер Бельштейна | 4347460 |
| Властивості | |
| Молекулярна формула | C35H48N8O11S |
| Молярна маса | 788,87 г/моль |
| Зовнішній вигляд | Needles |
| Тпл | 281 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Через здатність сполуки зв'язуватись з F-актином, похідні фалоїдину, що містять флюоресценті мітки, широко використовуються в мікроскопії з метою візуалізації F-актину в біохімічних дослідженнях.
Відкриття та значення
Фалоїдин був першим з відкритих циклічних пептидів. Його виділили та кристалізували з мухомору зеленого Феодор Лінен та Ульрих Віланд у 1937[1]. Аміноксилотну післідовновність фалоїдину було описано Віландом та Шеном у 1955 році з використанням методу розщеплення за Едманом[2].
Через високу афінність фалоїдину до актину, науковці використовують сполуку з метою фарбування для ефективної візуалізації актину в мікроскопії. З цією метою широко використовуються похідні фалоїдину зв'язані з флюорофорами. Такий метод фарбування є більш ефективним у порівнянні до методу з використанням актин-спеціфічних антитіл, через здатність фалоїдину до вибіркового зв'язування з філаментним актином (F-актин) а не з його мономерами (G-актин)[3].
Синтез
Біосинтез
Ген, що кодує синтез фалоїдину є частиною родини MSDIN і кодує пропептид довжиною 34-39 амінокислотних залишків. Точну послідовність кроків та біохімічних процесів необхідних для утворення фалоїдину з пропетиду досі до кінця не визначено і не описано, проте вважається, що усі гени необхідні для біосинтезу сполуки знаходяться в кластері генів MSDIN[4].
Хімічний синтез
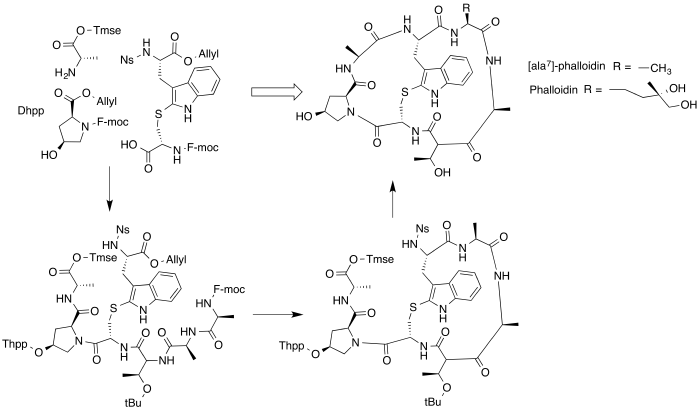
Зважаючи на значне практичне значення фалоїдину та його похідних в наукових дослідженнях розроблено методи штучного синтезу цих сполук.
Нижче наведено загальну схему синтезу використану Андерсоном і співаторами у 2005 з метою синтезу ала7-фалоїдину [на схемі: ala7-phalloidin], який відрізняється від фалоїдину залишком 7 аміокислоти (див схему)[5].
Симптоми
Невдовзі після відкриття фалоїдину, вчені визначили, що його LD50 для мишей становить 2 мг/кг. Смерть піддослідних тварин наставала протягом кількох діб після ін'єкції мінімальної летальної дози. Єдиним очевидним проявом дії фалоїдину є нестримний голод. Це, ймовірно, пов'язано з тим, що основна маса фалоїдину абсорбується печінкою[6]. Потрапивши до гепатоцитів фалоїдин зв'язується з F-актином унеможливлюючи його деполімеризацію. Через деякий час це призводить до загибелі клітин та некрозу печінки. Фалоїдин також може обсорбуватися клітинами нирок (у меншій мірі у порівнянні до гепатоцитів) спричиняючи нефроз[7].
Дія
Фалоїдин зв'язується з F-актином, унеможливлюючи його деполімеризацію, відтак отруюючи клітину. Фалоїдин специфічно зв'язується з ділянками між субодиницями F-актину, прив'язуючи сусідні субодиниці. Фалоїдин зв'язується з філаментами актину з більшою силою ніж з мономерами. Це змінює значення константи дисоціації кінцевих субодиниць філаментів актину, що призводить до стабілізації філаментів та унеможливлює деполімеризацію[8].
Використання в мікроскопії
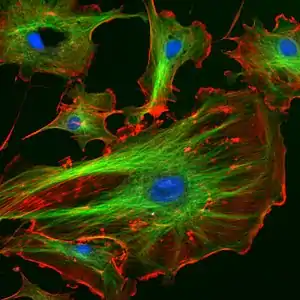
Властивості фалоїдину роблять його важливим засобом у вивченні розподілу F-актину в клітинах шляхом маркування молекул фалоїдину флюоресцентними маркерами і використання отриманої сполуки з метою фарбування філаментів актину для цілей світлової мікроскопії. Флюоресцентні похідні актину стали надзвичайно важливими для локалізацї філаментів актину як у живих та і у фіксованих клітинах, а також для візуалізації актину in vitro.
Див. також
Джерела
- Lynen F, Wieland U (18 листопада 1937). Uber die Giftstoffe des Knollenblätterpilzes. IV. Justus Liebigs Annalen der Chemie (нім.) 533 (1): 93–117. doi:10.1002/jlac.19385330105.
- Wieland T, Schon W (16 січня 1955). Über die Giftstoffe des grünen Knollenblätterpilzes X. Mitteilung. Die Konstitution des Phalloidins. Justus Liebigs Annalen der Chemie 593 (2): 157–178. doi:10.1002/jlac.19555930204.
- Immunohistochemistry: Basics and Methods.. Springer Science & Business Media. 2010. с. 92–3. ISBN 978-3-642-04609-4.
- Walton JD; Hallen-Adams He; Luo H (4 серпня 2010). Ribosomal biosynthesis of the cyclic peptide toxins of Amanita mushrooms. Peptide Science 94 (5): 659–654. doi:10.1002/bip.21416. Вказано більш, ніж один
|author1=та|last=(довідка); Вказано більш, ніж один|author2=та|last2=(довідка); Вказано більш, ніж один|author3=та|last3=(довідка); Вказано більш, ніж один|DOI=та|doi=(довідка) - A solid-phase approach to the phallotoxins: total synthesis of [ala7]-phalloidin. J. Org. Chem. 70 (12): 4578–84. 16 квітня 2005. doi:10.1021/jo0503153. Вказано більш, ніж один
|DOI=та|doi=(довідка) - Wieland T (1963). Chemical and toxicological studies with cyclopeptides of Amanita phalloides. Pure and Applied Chemistry 3 (6): 339–350. doi:10.1351/pac196306030339. Вказано більш, ніж один
|author=та|last=(довідка); Вказано більш, ніж один|DOI=та|doi=(довідка) - Schröder, Eberhard; Lübke, Klaus (2014). The Peptides, Volume II: Synthesis, Occurrence, and Action of Biologically Active Polypeptides. Elsevier. с. 475. ISBN 978-1-4832-5986-4.
- Cooper JA (October 1987). Effects of cytochalasin and phalloidin on actin. J. Cell Biol. 105 (4): 1473–8. PMC 2114638. PMID 3312229. doi:10.1083/jcb.105.4.1473. Вказано більш, ніж один
|author=та|last=(довідка); Вказано більш, ніж один|pmc=та|PMC=(довідка); Вказано більш, ніж один|DOI=та|doi=(довідка); Вказано більш, ніж один|pmid=та|PMID=(довідка)