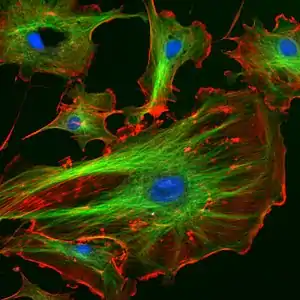
Цитоскелет
Цитоскелет — це клітинний каркас або скелет, що знаходиться в цитоплазмі живої клітини. Він присутній у всіх клітинах, як еукаріот (тварин, рослин, грибів та найпростіших), так і прокаріот. Це динамічна структура, що постійно змінюється, до функцій якої входить підтримка і адаптація форми клітини до зовнішніх дій, екзо- і ендоцитоз, забезпечення руху клітини як цілого, активний внутрішньоклітинний транспорт і клітинне ділення. Цитоскелет утворений білками. У цитоскелеті виділяють декілька основних систем, званих або за основними структурними елементами, помітними при електронно-мікроскопічних дослідженнях (мікрофіламенти, проміжні філаменти, мікротрубочки), або за основними білками, що входять в їхній склад (актин-міозинова система, кератинова система, тубулін-дінеїнова система).
Загальний план будови філаментів цитоскелету
Елементи цитоскелету є полімерами, мономерами яких виступають певні білкові субодиниці. На відміну від інших біополімерів, таких як самі білки чи нуклеїнові кислоти, структурні одиниці цитоскелету сполучені одне з одним слабкими нековалентними зв’язками. Полімерна будова вигідна через те, що дає змогу клітині швидко перегруповувати цитоскелет: білкові мономери маленькі, і вони можуть швидко дисоціювати у цитоплазмі, на відміну від довгих філаментів.
Проміжні філаменти складаються із субодиниць, які самі є видовженими фібрилярними білками, в той час як мономерами мікрофіламентів та мікротрубочок є глобулярні білки актин та тубулін відповідно. Білки цитоскелету можуть самоорганізовуватись у довгі філаменти, утворюючи різні типи латеральних контактів та контактів типу «хвіст-голова». У живій клітині цей процес регулюється величезною кількістю допоміжних білків.
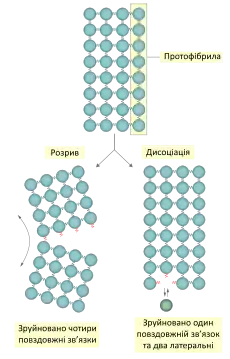
Елементи цитоскелету можуть бути одночасно динамічними і дуже міцними через те, що вони складаються із кількох протофіламентів — довгих лінійних ниток, побудованих із мономерів, розміщених в один ряд. Зазвичай протофіламенти спірально закручуються один навколо одного. Мікротрубочки складаються із тринадцяти протофіламентів розміщених по колу, мікрофіламенти — із двох спірально закручених, а проміжні філаменти — із восьми. Внаслідок такої будови дисоціація мономера із кінця фібрили відбувається значно легше ніж розрив посередині, так як для дисоціації необхідне руйнування тільки одного поздовжнього зв'язка і одного-двох латеральних, а для розриву — великої кількості поздовжніх зв'язків. Тому перебудова елементів цитоскелету відбувається відносно легко, і в той же час вони можуть легко протистояти тепловим пошкодженням і витримувати різні механічні впливи.
Елементи цитоскелету еукаріот
Основними функціями цитоскелету є підтримання форми клітини та забезпечення переміщення як клітини в цілому, так і внутрішньоклітинних компонентів всередині клітини. Цитоскелет складається з трьох основних компонентів: мікрофіламентів, мікротрубочок та проміжних філаментів. Це супрамолекулярні, протяжні полімерні структури, що складаються з білків одного типу.
| Порівняльна характеристика основних елементів цитоскелету[1] | |||
|---|---|---|---|
| Фотографія | 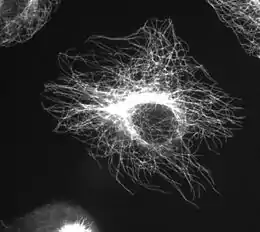 Мікротрубочки. Імунофлюоресцентне зображення в фіксованій клітині. | 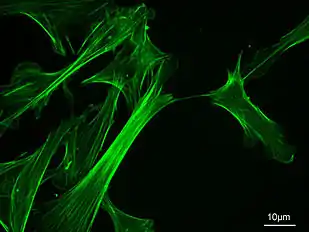 | 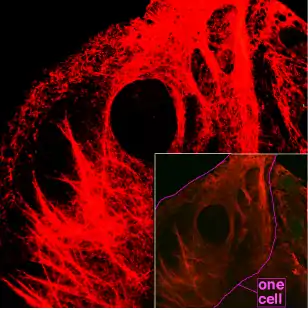 Кератинові філаменти у клітинах ембріональної карциноми F9. |
| Схема будови | 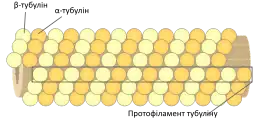 |  |  |
| Струкутра | Трубка із 13 протофіламентів білка тубуліну | Два закручених одне навколо одного протофіламенти актину | Кілька протофіламентів, що складаються із фібрилярних білків об’єднані у канатоподібну структуру |
| Діаметр | 25нм із просвітом у 15 нм | 7 нм | 8-12нм |
| Білкові субодиниці | Тубулін – димер, що складається із α- та β-тубуліну | Актин | Різні білки в залежності від типу клітин і функції (наприклад кератин, білки ламіни, віментин тощо) |
| Нуклеотиди потрібні для полімеризації | ГТФ | АТФ | Не потрібні |
| Основні функції |
|
|
|
Динаміка елементів цитоскелету
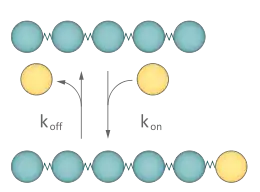
Елементи цитоскелету є динамічними структурами: їх можна порівняти із ланцюжком мурашок, що ідуть до місця збору їжі. Хоча сам ланцюжок може існувати годинами, кожна мурашка в ньому перебуває у постійному русі. Так само і елементи цитоскелету постійно обмінюються субодиницями із цитоплазмою, де мономери перебувають у розчинній формі. Відносною стабільністю характеризуються тільки проміжні філаменти, тому інформація про динаміку стосується більшою мірою мікротрубочок та актинових філаментів.
Прикладом динамічності та гнучкості цитоскелету клітини може бути перегрупування мікротрубочок, які в інтерфазі утворюють структуру схожу на зірку, промені якої відходять від центру клітини, а перед поділом здатні швидко утворити веретено поділу. В той же час деякі структури, побудовані із елементів цитоскелету можуть існувати дуже довгий час: наприклад на поверхні волоскових клітин внутрішнього вуха є вирости — стереоцілі, що підтримуються пучками мікрофіламентів. Ці пучки існують впродовж всього життя тварини, хоча їхні субодиниці постійно оновлюються
Швидкість приєднання та дисоціації субодиниць описується константами kon (вимірюється в М-1×с-1)та koff (вимірюється у с-1) відповідно. При чому швидкість приєднання залежить не тільки від kon, а й від концентрації вільних мономерів у цитоплазмі, а швидкість дисоціації є сталою. Коли філамент росте, то кількість вільних мономерів у цитоплазмі падає, допоки не досягне певного рівня — критичної концентрації (CC), за якої швидкість приєднання буде рівна швидкості дисоціації: CC×kon = koff, звідки:
Нуклеація
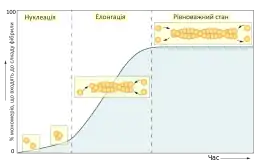
Мономери елементів цитоскелету можуть спонтанно утворювати комплекси у розчині. Проте, такі олігомери зазвичай нестабільні, через те, що кожна субодиниця в них утворює зв'язки тільки із невеликою кількістю інших. Цих взаємодій часто недостатньо, щоб утримати комплекс, і він переважно швидко розпадається. Для утворення довгих філаментів необхідна наявність початкового агрегату із такої кількості мономерів, якої буде достатньо для стабілізації, такий агрегат називається ядром, а процес його утворення — нуклеацією. Для актинових філаментів, ядро повинно складатись мінімум із трьох субодиниць, тоді як утворення мікротрубочок починається із складнішого комплексу (імовірно, із 13 молекул тубуліну, що утворюють кільце).
Нуклеація зазвичай є лімітуючим етапом в утворенні довгих філаментів у розчині вільних мономерів. Після ініціації полімеризації у такому розчині спостерігається лаг-фаза, під час якої не спостерігається утворення філаментів. Її існування пояснюється тим, що нестабільність невеликих олігомерів створює кінетичний бар'єр у полімеризації, і триває вона доти, доки не відбудеться процес нуклеації. Якщо до розчину мономерів додати готові комплекси субодиниць (наприклад такі, що складаються із з'єднаних ковалентно мономерів), тоді лаг-фази спостерігатись не буде.
Потреба у нуклеації використовується клітиною для регулювання утворення нових елементів цитоскелету. Існують спеціальні білки, які можуть каталізувати нуклеацію у специфічному місці, де необхідне утворення мікротрубочок або актинових філаментів.
Полярність мікротрубочок та мікрофіламентів
На відміну від мономерів проміжних філаментів, актин та тубулін мають два структурно та функціонально різні кінці. У складі мікрофіламентів та мікротрубочок всі субодиниці повернуті в одну сторону, таким чином дані елементи цитоскелету володіють полярністю. Два кінці цих філаментів відрізняються за динамікою полімеризації та деполімеризації:
- кінець, на якому полімеризація та деполімеризація відбуваються швидше називається плюс-кінцем;
- кінець, на якому полімеризація та деполімеризація відбуваються повільніше називається мінус-кінцем.
У мікротрубочках α-субодиниці тубуліну повернуті до мінус-кінця, а β – до плюс. В мікрофіламентах мономери актину розміщені таким чином, що їх АТФ-зв'язуюча щілина вказує в сторону мінус кінця.
Не зважаючи на те, що абсолютні занчення kon та koff можуть сильно відрізнятись для плюс та мінус кінця, їх співвідношення є сталою величиною. Оскільки зміна вільної енергії ΔG внаслідок дисоціації чи приєднання нової субодиниці є однаковою, не в залежності від того на якому кінці філамента відбулись зміни. Через це, коли концентрація вільних мономерів C < CC, обидва кінці вкорочуються, а коли C > CC, обидва кінці ростуть. Це справджується тільки за умов відсутності гідролізу нуклеозидтрифосфатів (АТФ чи ГТФ).
Гідроліз нуклеотидтрифосфатів

Актин та тубулін — це не просто мономери елементів цитоскелету, вони також є ферментами, які можуть здійснювати гідроліз АТФ та ГТФ відповідно. Одна молекула актину зв'язує одну молекулу АТФ, тоді як димер тубуліну — дві молекули ГТФ (по одній на кожну субодиницю), той ГТФ, що знаходиться в α-субодиниці ніколи не гідролізуєтья і не обмінюється, тоді як ГТФ β-субодиниці може перетворюватись на ГДФ.
У вільних мономерах актину та тубуліну гідроліз нуклеотидів відбувається дуже повільно, для пришвидшення цього процесу необхідна дія певного фактора — ГТФаза- або АТФаза-активуючих білків. При чому для тубуліну та актину такими факторами є інші молекули тубуліну чи актину відповідно, тому гідроліз нуклеотидтрифосфату значно прискорюється після інкорпорації мономеру у філамент цитоскелету, де він взаємодіє з іншими ідентичинми молекулами. Мікротрубочки та мікрофіламенти можуть існувати у двох формах «Т-формі» (мономери зв'язані із ГТФ чи АТФ) та «Д-формі» (мономери зв'язані із ГДФ чи АДФ).
Після гідролізу нуклеотидтрифосфату велика частина енергії, що вивільняється «зберігається» у структурі філаменту. Через це зміна вільної енергії для дисоціації мономеру із Д-форми стає негативнішою, ніж для дисоціації із Т-форми, а отже і співвідношення koff/kon, яке рівне значенню критичної концентрації, буде більше для Д-форми, ніж для Т. Іншими словами, Д-форма більш «схильна» до дисоціації. При певному значенні концентрації вільних субодиниць C, коли CC(T) < C < CC(D), Т-форма філаментів буде рости, а Д-форма — вкорочуватись.
Тредмілінг

Імовірність того, що певна субодиниця філаменту цитоскелету гідролізує зв'язаний нуклеотидтрифосфат і перейде у Д-форму, тим більша, чим довше ця субодиниця перебуває у складі полімеру. Тому посередині філаменту, де всі мономери вже «давні», вони мають у своєму складі нуклеотиддифосфати. До кінців приєднуються переважно нові молекули у Т-формі (оскільки концентрація АТФ чи ГТФ у цитоплазмі в десятки разів перевищує концентрацію АДФ та ГДФ відповідно). На мінус-кінці полімеризація відбувається повільно, тому гідроліз «встигає» за нею, і не відбувається накопичення субодиниць у Т-формі. Натомість на плюс-кінці, де полімеризація значно швидша, утворюється «кеп» із кількох субодиниць, що містять негідролізовані нуклеотидтрифосфати. Таким чином один кінець (+) філамента перебуває у Т-формі, а інший (-) — у Д-формі і при концентрації вільних філаментів C, де CC(T) < C < CC(D), плюс-кінець ростиме, а мінус- — вкорочуватиметься, а загальна довжина не буде змінюватись. Цей процес називається тредмілінг, він спостерігається як у мікротрубочок, так і в актинових філаментів, але характерніший для останніх. Тредмілінг завжди потребує енергії, що виділяється за рахунок гідролізу АТФ.
Динамічна нестабільність
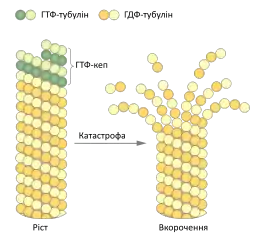
В залежності від швидкості полімеризації та гідролізу нуклеотидтрифосфатів кінці філаментів цитоскелету можуть змінювати свій стан: переходити із Т-форми у Д-форму і навпаки. Якщо концентрація вільних філаментів при цьому менша за CC(T) і більша за CC(D), то такий перехід буде мати важливі наслідки: філамент буде переходити від росту до вкорочення (ця подія називається катастрофа) або навпаки (відновлення). Здатність елементів цитоскелету швидкої зміни «режимів» полімеризація/деполімеризація за сталої концентрації вільних субодиниць називається динамічною нестабільністю.
Явище динамічної нестабільності особливо характерне для мікротрубочок. У Т-формі їхні протофіламенти прямі, а при переході до Д-форми вони викривлюються. Коли мікротрубочка має ГТФ-кеп, він стабілізує всю структуру, проте після її втрати (через сповільнення полімеризації або пришвидшення гідролізу) протофіламенти у Д-формі починають дуже швидко «розлуплюватись».
Також спостерігаються деякі флуктуації довжини актинових філаментів, проте вони у десяток разів менші ніж у мікротрубочок.
Отрути, що впливають на цитоскелет еукаріот
Оскільки нормальне функціонування системи мікротрубочок та проміжних філаментів є необхідним для виживання та поділу кілтини, ці клітинні компоненти часто є мішенями дії природних токсинів. Деякі із цих отрут зв'язуються із вільними мономерами актину чи тубуліну і перешкоджають їм полімеризуватись, інші ж навпаки — взаємодіють із полімерними формами і не допускають дисоціації мономерів. Наприклад речовина таксол із тихоокеанського тису (Taxus brevifolia) стабілізує мікротрубочки у полімеризованій формі, в той час як колхіцин із пізньоцвіту осіннього (Colchicum autumnale) та вінбластин із катарантуса (Catharanthus) навпаки не дають мономерам тубуліну об'єднуватись. Існують речовини, що аналогічним чином діють і на актинові філаменти: фалоїдин із блідої поганки (Amanita phalloides) сприяє філаментозній формі актину, а латрункулін із морської губки Latrunculia magnifica — навпаки, розчинній мономерній.
| Деякі із отрут, що впливають на цитоскелет та організми, з яких вони були виділені | ||||||||
|---|---|---|---|---|---|---|---|---|
 | 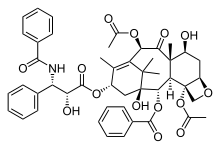 |  |  |  | 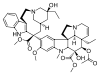 |  | 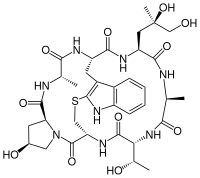 | 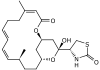 |
| Тис тихоокеанський | Таксол | Пізньоцвіт осінній | Колхіцин | Катарантус | Вінбластин | Бліда поганка | Фалоїдин | Латрункулін |
Окрім того, що подібні речовини широко використовуються для вивчення властивостей цитоскелету, деякі із них також є і терапевтичними препаратами. Таксол та вінбластин завдяки своїй здатності змінювати характер полімеризації мікротрубочок здатні досить ефективно вбивати клітини, котрі швидко діляться, при цьому проявляючи невеликий вплив на інші клітини. Через це їх використовують для лікування ракових захворювань. Особливо популярним є таксол для терапії раку молочної залози та раку легень, він часто буває ефективним навіть у тих випадках, коли інші методи хіміотерапії не діють.
Цитоскелет прокаріот
- Основна стаття:Цитоскелет прокаріот
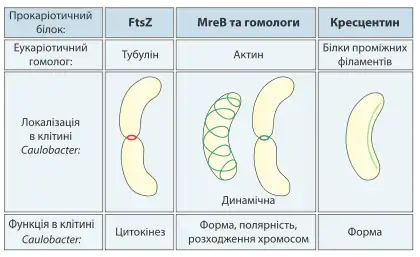
До недавнього часу вважалося, що цитоскелет мають тільки еукаріоти. Але останні дослідження показують, що для всіх складових частин еукаріотичного цитоскелету можна знайти гомологи у прокаріот. Хоча схожість в амінокислотній послідовності білків невелика, відновлення тривимірної структури білкових молекул дозволяє говорити про значну структурну схожість і гомологічність цих структур.
- Гомологи тубуліну: із гомологів тубуліну найпоширенішим серед прокаріот є білок FtsZ, що був першим знайденим компонентом прокаріотичного цитоскелету. Подібно до тубуліну, FtsZ формує філаменти витрачаючи ГТФ, але ці філаменти не групуються в трубочки. Протягом поділу клітини, FtsZ — перший білок, що переміщується на місце поділу, формуючи «кільце поділу» або Z-кільце, яке забезпечує проходження цитокінезу, також FtsZ важливий для залучення ферментів, які синтезують нову клітинну стінку між дочірними клітинами.[2]
- Гомологи актину: MreB і ParM — це актино-подібні білки прокаріот. MreB потрібний для надання форми клітині, зокрема відповідає за відмінність між піличкоподібними та спіральними бактеріями. Всі несферичні бактерії мають гени MreB або його близьких гомологів. Продукти цих генів формують спіральну мережу під клітинною мембраною, яка слугує для утримання ферментів, задіяних у біосинтезі клітинної стінки. Білок ParM кодується плазмідною ДНК багатьох бактерій і потрібний для сегрегації копій плазміди під час поділу.[3]
- Гомолог білків проміжних філаментів кресцентин: бактерія Caulobacter crescentus містить третій білок, кресцентин, гомологічний проміжним філаментам еукаріот. Кресцентин також використовується для підтримки форми клітини.[3]
- Елементи цитоскелету прокаріот, що не мають гомологів в еукаріот: у прокаріот також наявний клас елементів цитоскелету, що належать до родини WACA (англ. Walker A cytoskeletal ATPase) і не мають гомологів в еукароіт. До цього класу належить білок MinD, який є складовою системи MinCDE, що забезпечує визначення місця проходження цитокінезу, а також білки, потрібні для розходження копій плазмід, такі як ParA, Soj та інші.[3]
Еволюція цитоскелету
Споріднені між собою елементи цитоскелету були знайдені у переважної більшості представників усіх трьох доменів живих організмів: еукаріот, бактерій та архей. Це свідчить про те, що білки цитоскелету виникли ще до виокремлення цих трьох гілок, яким би шляхом воно не відбувалось.[4]
Білок FtsZ, із якого пізніше виник тубулін, імовірно, еволюційно є дуже древнім. Він містить дуже мало амінокислот аргініну, лізину, фенілаланіну, тирозину та гістидину і фактично не містить триптофану. Оскільки вважається, що кодони цих амінокислот були додані в генетичний код останніми, цілком імовірно, що якась форма FtsZ виникла ще до остаточного встановлення генетичного коду і вже тоді слугувала для здійснення цитокінезу.[5] Білки гомологи тубуліну утворюють окрему родину ГТФаз, і не мають ніяких близьких родичів. Натомість MreB більш «молодий» з еволюційної точки зору білок, він, разом із іншими актиноподібними білками та актинами, належить до родини АТФаз, яка також включає ферменти гексокінази та шаперон hsp70. При чому першими із цієї родини, більше всього, виникли гексокінази.[4]
Порівняння послідовностей амінокислот у білках FtsZ різних видів бактерій та архей між собою та з еукаріотичними тубулінами, а також MreB між собою і з еукаріотичними актинами виявило цікаву закономірність:
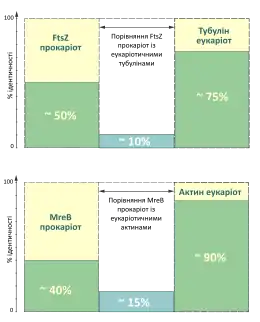
- Білки FtsZ дуже далеких одне від одного видів прокаріот, таких як бактерії Escherichia coli, Bacillus subtilis, Mycoplasma pulmonis та архебактерія роду Halobacterium мали високий ступінь ідентичності в амінокислотній послідовності (від 46 до 53%); аналогічне справедливе і для білка MreB.
- Еукаріотичні тубуліни та актини навіть ще більш консервативні (напирклад між тубулінами людини та дріжджів існує 75% ідентичності, в той час як актини будь-яких видів еукаріот, зазвичай відрізняються не більше ніж на 10%);
- Не зважаючи на велику консервативність білків цитоскелету в межах груп еукаріот та прокаріот, при порівнянні цих білків між групами, виявляється, що ідентичність настільки мала, що її майже не можливо виявити звичайними методами (менше 15%). При чому гомологія найбільш виражена у ГТФ- та АТФ-зв'язуючих доменах.[4]
Для пояснення цієї «загадки» була висунута гіпотеза про те, що така різка дивергенція еукаріотичних білків цитоскелету від прокаріотичних відбулась внаслідок зміни їхньої ролі в клітині. FtsZ перестав забезпечувати проходження цитокінезу і став механічною опорою клітини, а пізніше перебрав на себе і інші функції, в той час як MreB, взяв на себе роль здійснення поділу клітини і фагоцитозу.
Надзвичайно високий рівень косервативності актину та тубуліну в клітинах еукаріот пояснюється тим, що ці білки взаємодіють із величезною кількістю інших: регуляторних, допоміжних, моторних тощо. Саме актин є «чемпіоном» серед еукаріотичних білків за кількістю білків-партнерів, тому заміна будь-якої амінокислоти може призвести до порушення цих взаємодій і мати катастрофічні наслідки.[4]
Третій тип елементів цитоскелету — проміжні філаменти, еволюціонували іншим шляхом. Вони наявні фактично тільки в еукаріот, і хоча їх гомолог кресцентин і був виявлений в одного виду бактерій, швидше за все, ці бактерії отримали його внаслідок горизонтального перенесення генів від еукаріот.[4] Білки проміжних філаментів, на відміну від актину і тубуліну, не вирізняються особливою консервативністю.
Джерела
- Campbell NA, Reece JB (2008). Biology (вид. 8th). Benjamin Cammings. ISBN 978-0321543257.
- Erickson HP, Anderson DE, Osawa M (2010). FtsZ in Bacterial Cytokinesis: Cytoskeleton and Force Generator All in One. Microbiol Mol Biol Rev 74: 504–28. PMID 21119015. doi:10.1128/MMBR.00021-10.
- Thanbichler M, Shapiro L (2008). Getting organized--how bacterial cells move proteins and DNA. Nat Rev Microbiol 6: 28–40. PMID 18059290. doi:10.1038/nrmicro1795.
- Erickson H.P. (2007). Evolution of the cytoskeleton. BioEssays 29: 668–77. PMID 17563102. doi:10.1002/bies.20601.
- Davis BK (2002). Molecular evolution before the origin of species. Prog Biophys Mol Biol 79: 77–133. PMID 12225777. doi:10.1016/S0079-6107(02)00012-3.
Література
Підручники
- Альбертс Дж., Льюїс Р., Робертс В. Молекулярна Біологія Клітини (вид. 4). Львів: Наутілус. Архів оригіналу за 16 липня 2014. Процитовано 22 вересня 2011.
- Ченцов Ю.С. (2004). ВВедение в клеточною биологию: Учебник для вузов (вид. 4). Москва: ИКЦ «Академкнига». с. 495. ISBN 5-94628-105-4.
- Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2007). Molecular Biology of the Cell (вид. 5th). Garland Science. ISBN 978-0-8153-4105-5.
- H. Lodish, A. Berk, S.L. Zipursky, P. Matsudaira, D. Baltimore, J. Darnell (2000). Molecular Cell Biology (вид. 4th). W. H. Freeman. ISBN 10: 0-7167-3136-3 Перевірте значення
|isbn=(довідка). - G. M. Cooper (2000). The Cell A Molecular Approach (вид. 2nd). Sinauer Associates. ISBN 10: 0-87893-106-6 Перевірте значення
|isbn=(довідка).
Періодична література
- Cytoskeleton Online ISSN 1949-3592 (Коефіцієнт впливовості — 2.625)
- Cell Motility and the Cytoskeleton Online ISSN 1097-0169 (Коефіцієнт впливовості — 2.840)