Флавінаденіндинуклеотид
Флавінаденіндинуклеотид, ФАД — кофермент, що бере участь в окисно-відновних метаболічних процесах. Як простетична група входить до складу багатьох ферментів флавінопротеїнів (флавопротеїни можуть містити інший флавіновий кофермент — ФМН).
| Флавінаденіндинуклеотид | |
|---|---|
 Кульково-стрижнева модель ФАД | |
| Ідентифікатори | |
| Номер CAS | 146-14-5 |
| PubChem | 703 |
| Номер EINECS | 205-663-1 |
| DrugBank | DB03147 |
| KEGG | D00005 |
| Назва MeSH | Flavin-Adenine+Dinucleotide |
| ChEBI | 16238 |
| SMILES |
Cc1cc2nc3c(nc(O)nc3=O)n(CC(O)C(O)C(O)COP(O)(=O)OP(O)(=O)OCC3OC(C(O)C3O)n3cnc4c(N)ncnc34)c2cc1C |
| InChI |
1/C27H33N9O15P2/c1-10-3-12-13(4-11(10)2)35(24-18(32-12)25(42)34-27(43)33-24)5-14(37)19(39)15(38)6-48-52(44,45)51-53(46,47)49-7-16-20(40)21(41)26(50-16)36-9-31-17-22(28)29-8-30-23(17)36/h3-4,8-9,14-16,19-21,26,37-41H,5-7H2,1-2H3,(H,44,45)(H,46,47)(H2,28,29,30)(H,34,42,43) |
| Номер Бельштейна | 1208946 |
| Номер Гмеліна | 108834 |
| 3DMet | B04619 |
| Властивості | |
| Молекулярна формула | C27H33P2N9O15 |
| Молярна маса | 785,5497 г/моль |
| Кислотність (pKa) | 1,128 |
| Основність (pKb) | 12,8689 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
ФАД утворюється із вітаміну B2 (рибофлавіну) шляхом конденсації із аденозиндифосфатом (АДФ).
Ізоалоксазинове кільце ФАД може приєднувати електрони та протони, завдяки чому коферемент виконує функцію переносника. На відміну від іншого переносника електронів — НАД — ФАД може відновлюватись повністю (ФАДH2), приєднуючи два електрони та два протони або частково (семіхінон ФАД•), приєднуючи тільки один електрон і протон:
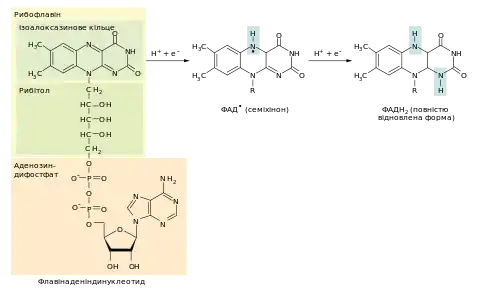
Це дозволяє ФАД виконувати ширший спектр функцій, ніж НАД.
Окиснення та відновлення ФАД можна відстежити за зміною спектру полглинання:
- повністю відновлена форма ФАДH2 має максимум поглинання при 360 нм;
- семіхінон ФАД• — при 370 нм;
- окиснена форма ФАД — два піки при 370 та 440 нм.
Ще однією особливістю ФАД у порівнянні з НАД, є те, що він не переносить електронів дифундуючи від одного ферменту до іншого. Флавінаденіндинуклеотид переважно міцно, інколи навіть ковалентно (як у випадку сукцинатдегідрогенази), приєднаний до білка і надає йому можливість утримувати електрони під час їх перенесення від донора до акцептора.
В залежності від того, з яким білком зв'язаний ФАД його окисно-відновний потенціал може змінюватись. Для вільного коферменту він становить −0,219 В, у складі сукцинатдегідрогенази — близький до 0,0 В, для інших флавопротеїнів змінюється у діапазоні від +0,06 до −0,4 В.
Деякі із ферментів, що містять у своєму складі ФАД:
- Ацил-КоА дегідрогеназа, яка бере участь у β-окисненні жирних кислот;
- Дигідроліпоїлдегідрогеназа — складова піруватдегідрогеназного комплексу;
- Сукцинатдегідрогеназа — один із ферментів циклу Кребса, окиснення ФАДH2, утвореного в реакції каталізованій сукцинатдегідрогеназою, спряжене із синтезом 1,5 молекул АТФ;
- Гліцерол-3-фосфат дегідрогеназа, що бере участь у транспорті відновних еквівалентів із цитозолю в мітохондрії у скелетних м'язах та мозку;
- Тіоредоксин редуктаза, потрібна для відновлення багатьох сполук в організмі, зокрема синтезу дезоксирибонуклеотидів із рибонуклеотидів.
Джерела
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Губський Ю.І. (2007). Біологічна хімія. Київ-Вінниця: Нова книга. с. 656. ISBN 978-966-382-017-0.
