ЯМР-спектроскопія
ЯМР-спектроскопі́я (Ядерна магнітно-резонансна спектроскопія; англ. Nuclear magnetic resonance spectroscopy) — метод ідентифікації та вивчення речовин, що базується на ядерному магнітному резонансі (ЯМР). Найчастіше застосовується для органічних сполук. На сьогодні ЯМР-спектроскопія дозволяє ідентифікувати сполуку маючи менше 1 мг речовини. Зразок розчиняють в непротонному (часто дейтерованому) розчиннику, ампулу (кювету) вміщують в ЯМР-спектрометр, після нетривалого (для простих сполук порядку 30 сек) накопичення сигналу отримують спектр, де по положенню (частоті поля збудження), інтенсивності та мультиплетності піків окремих ядер характеризують сполуку. Широкому використанню заважає тільки висока ціна пристроїв (від 1 мільйона гривень та вище). Для методу доступні всі ядра, що мають не нульовий спін, зокрема 1H, 13С, 15N 19F, 31P, 29Si.
Теоретичні основи методу
ЯМР активними є ядра з не нульовим ядерним спіном (проявляють магнітні властивості), величина якого залежна від так званого спінового квантового числа — I, яке може набирати значень 0, 1/2, 1, 3/2, 2, 5/2 … Числове значення спінового квантового числа залежить від кількості протонів та нейтронів у ядрі. Так, ізотопи, які мають парне число протонів та нейтронів (12С, 16О) мають нульовий спін; ізотопи з не парним числом протонів і нейтронів (14N, 2H) володіють цілочисельним спіном, а ізотопи які мають парне число протонів і не парне число нейтронів (або навпаки) характеризуються дробовим значенням спінового квантового числа. Ядра зі спіном 1/2 називають дипольними (диполями), в той час як ядра зі спіном більшим за 1/2 називають квадрупольними (квадруполями)[1].
| Кількість протонів | Кількість нейтронів | Спінове квантове число, I |
|---|---|---|
| Парна | Парна | 0 |
| Не парна | Не парна | 1, 2, 3 … |
| Парна | Не парна | 1/2, 3/2, 5/2 … |
| Не парна | Парна | 1/2, 3/2, 5/2 … |
При внесенні речовини (яка містить ядра з не нульовим спіном) у зовнішнє магнітне поле, ядерні спіни, які мали хаотичну орієнтацію, починають орієнтуватись вздовж ліній напруженості зовнішнього магнітного поля, подібно до того як стрілка компаса орієнтується вздовж ліній напруженості магнітного поля Землі. Проте, на відміну від стрілки компаса, ядерний спін є векторною величиною і його напрямок та енергія (значення) є квантованими. Отже, в присутності зовнішнього магнітного поля, ядерні спіни можуть приймати 2I+1 орієнтацій (де I — спінове квантове число). Кожна орієнтація відповідає певному енергетичному рівню. Так, на приклад, ядра зі спіном 1/2 при внесенні у зовнішнє магнітне поле будуть приймати дві орієнтації — за полем (α, нижчий енергетичний рівень) і проти поля (β, вищий енергетичний рівень). При чому кількість спінів орієнтованих за полем буде незначно більшою за кількість спінів орієнтованих проти поля. Співвідношення між кількістю спінів у різних орієнтаціях визначається розподілом Больцмана: Nα/Nβ = exp(-ΔE/kT), де ΔE — різниця енергії між енергетичними рівнями (Зееманівські енергетичні рівні) різнонаправлених спінів[2].
Чутливість до різних ядер
Для ЯМР аналізу придатні лише ядра з не нульовим спіном. Чутливість експерименту прямопропорційна до (абсолютного значення) гіромагнітного співвідношення (специфічна характеристика кожного ізотопу) та природного вмісту досліджуваних ядер. Також важливий вплив на чутливість має числове значення ядерного спіну. Чутливість експерименту до ядер зі спіном рівним 1/2 (так звані дипольні ядра) зазвичай є вищою ніж до ядер зі спіном більшим ніж 1/2 (так звані квадрупольні ядра) через швидку (зазвичай) релаксацію останніх, а також через розширення і ускладнення ЯМР сигналу за рахунок квадрупольних взаємодій.
| Ізотоп | Природний вміст (%) |
Спін | Гіромагнітне співвідношення, γn (106 рад·с−1·Т−1) | Застосування для аналізу структури |
Частота на 7 T (MHz) |
Відносна чутливість |
|---|---|---|---|---|---|---|
| 1H | 99,984 | 1/2 | 267,522 | найширше | 300,13 | 1 |
| 2H | 0,016 | 1 | 41,065 | рідко | 46,07 | 0,00965 |
| 10B | 18,8 | 3 | 28,740 | рідко | 32,25 | 0,0199 |
| 11B | 81,2 | 3/2 | 85,84 | рідко | 96,29 | 0,165 |
| 12C | 98,9 | 0 | неможливе | |||
| 13C | 1,1 | 1/2 | 67,282 | часто | 75,47 | 0,0159 |
| 14N | 99,64 | 1 | 19,331 | дуже рідко | 21,68 | 0,00101 |
| 15N | 0,37 | 1/2 | -27,116 | аналіз білків | 30,41 | 0,00104 |
| 16O | 99,76 | 0 | неможливе | |||
| 19F | 100 | 1/2 | 251,662 | спецзадачі, аналіз | 282,40 | 0,834 |
| 28Si | 92,28 | 0 | неможливе | |||
| 29Si | 4,70 | 1/2 | −53,190 | рідко | 59,63 | 0,0785 |
| 31P | 100 | 1/2 | 108,291 | рідко | 121,49 | 0,0664 |
Хімічний зсув
Хімічний зсув — це відносна величина, прийнята для полегшення порівняння ЯМР спектрів, отриманих на спектрометрах з різною робочою частотою. Вимірюється хімічний зсув у мільйонних долях, м. д. (англ. part per million, ppm), що дорівнює різниці частоти поглинання досліджуваного ядра і стандарту (в Гц), поділеній на частоту ЯМР-спектрометра в Гц і домноженій на 106. Хімічний зсув залежить від екранування досліджуваного ядра сусідніми групами (особливо кратними зв'язками) та від електронної густини на атомі.
| ядро | Природний вміст, % | Відносна чутливість, % | Типовий діапазон, м. д. | Стандарт, 0 м д. | Помітки |
|---|---|---|---|---|---|
| 1H (Гідроген) | 100 | 100 | -1…14 | ТМС | Рутинні аналізи |
| 2D (Дейтерій) | <1 | 0.965 | Спеціальні застосування | ||
| 13C (Вуглець) | 1 | 1,59 | 0…200 | ТМС | Рутинні аналізи |
| 31P (Фосфор) | 100 | 6,64 | -250…300 | H3PO4 | ДНК, ліпіди |
| 19F (Флюор) | 100 | 83,4 | -300...50 | CFCl3 | Флуоровмісні органічні сполуки |
Протонний ЯМР
Стандарти — тетраметил силан (ТМС, англ.: TMS), хімічний зсув 0 ppm; гексаметилдисилоксан (англ.: HMDSO), хімічний зсув 0,05 ppm; Натрій триметилсилілпропансульфонат (англ.: DSS), хімічний зсув основного ЯМР сигналу -0,018 ppm.
Діапазон −0,5…+14 ppm для більшості сполук.
- Ароматика (слабке поле)
- Аліфатика
- O-CH3
- O-H
13C
Таблиця хімзсувів (коротка версія)
19F
Дуже чутливий, але діапазон частот лежить близько до протонного. Використовують для аналізу фторорганічних сполук.
31Р
−250…300
Інші
Рідко використовуються самостійно через низький природний вміст/чутливість.
Спін-спінова взаємодія
Взаємодія магнітних моментів сусідніх ядер, що призводить до розщеплення спектральних ліній на мультиплети. Не залежить від частоти спектрометра Типові значення для протонів
| Ядра | Система | Діапазон | Приклад | Гц |
|---|---|---|---|---|
| HH | HCCH (аліфатичні) | 0..10 | CH3CH2OH | 6 |
| H-H | HCCH (ароматичні) | 0..10 | CH3CH2OH | 6 |
| C-H | CH (аліфатичні) | CH3CH2OH | ||
| C-H | CH (ароматичні) | C6H6 | ||
| F-H | FCCH (аліфатичні) | CF3CH2OH | ||
| P-H | PH (ароматичні) | HPO(OH)2 | 700 |
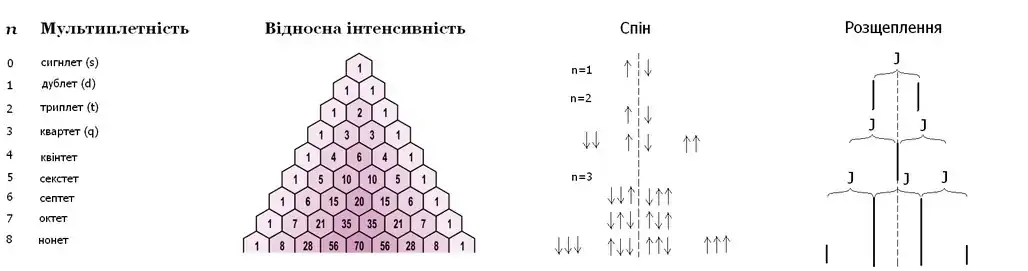
Нижче показаний трикутник Паскаля. Відносні інтенсивності ліній у мультиплетах першого порядку. Тут n — число сусідніх ядер із спіном 1/2, які мають однакові константи спін-спінової взаємодії.
Розчинники для ЯМР
Для ЯМР аналізу зазвичай використовують дейтеровані розчинники для того, щоб запобігти появі дуже інтенсивних сигналів від молекул розчинника, що містить протони, в спектрах 1Н (найчастіше використовуваний тип експерименту). Іншою причиною вживання дейтерованих розчинників є те, що сучасні спектрометри використовують сигнал від дейтерію (2D) для коригування магнітного поля спектрометра і покращення його роздільної здатності. Така процедура називається «локуванням» (field frequency lock) і є (зазвичай) одним з необхідних етапів налаштування спектрометра перед початком експерименту.
Будь-який дейтерований розчинник насправді не має всі 100 % протонів заміщених дейтерієм. Тому невелика кількість протонованих молекул розчинник все таки буде присутня у досліджуваному розчині, що призведе до появи малоінтенсивних сигналів від цих молекул в спектрах 1Н. Хімічні зсуви залишкових сигналів 1Н від дейтерованих розчинників є затабульованими і часто використовуються для калібрування спектрів.
На практиці часто буває, що розчинник (а іноді і досліджувана речовина) містить сліди води. В наслідок цього на 1Н спектрах часто можна побачити сигнал від води. Хімічний зсув цього сигналу залежить від розчинника, у якому присутні домішки води. Нижче наведена таблиця хімічних зсувів залишкових 1Н сигналів та сигналів 13С від розчинників, а також хімічні зсуви від слідів води у цих розчинниках.
| Розчинник | Хімічний зсув
залишкових 1Н сигналів, м. д. |
Хімічний зсув
13С сигналів, м. д. |
Хімічний зсув 1Н
сигналів від води у даному розчиннику, м. д. |
|---|---|---|---|
| Ацетатна кислота — d4 | 11,65
2,04 |
178,99
20,0 |
11.5 |
| Ацетон — d6 | 2,05 | 206,68
29,92 |
2,8 |
| Ацетонітрил — d3 | 1,94 | 118,69
1,39 |
2,1 |
| Бензен — d6 | 7,16 | 128,39 | 0,4 |
| Хлороформ — d | 7,24 | 77,23 | 1,5 |
| Циклогексан — d12 | 1,38 | 26,43 | 0,8 |
| Дейтерій оксид (D2O) | 4,8 | - | 4,8 |
| N, N диметилформамід — d7 | 8,03
2,92 2,75 |
163,15
34,89 29,76 |
3,5 |
| Дтметилсульфоксид — d6 | 2,50 | 39,51 | 3,3 |
| Етанол — d6 | 5,19
3,56 1,11 |
56,96
17,31 |
5,3 |
| Метанол — d4 | 4,78
3,31 |
49,15 | 4,9 |
| Тетрагідрофуран — d8 | 3,58
1,73 |
67,57
25,37 |
2,4-2,5 |
| Піридин — d5 | 8,74
7,28 7,22 |
150,35
135,91 123,87 |
5 |
| Толуен — d8 | 7,09
7,00 6,98 2,09 |
137,86
129,24 128,33 125,49 20,4 |
0,4 |
Техніки
Перетворення Фур'є
Дискретне перетворення Фур'є Застосовується в більшості сучасних спектрометрів. Дозволяє записувати одночасно сигнали всіх ядер потрібного елемента. Практичного застосування набуло лиш в 1980-х після удосконалення комп'ютерної техніки.
Теоретична основа
Збуджують всі ядра одночасно широким сигналом, а потім записують криву спаду. ПФ дозволяє отримати спектр в частотному вимірі. Зробивши набір математичних операцій над кривою спаду інтенсивності (FID). В той же час перші моделі ЯМР-спектрометрів збуджували ядра «по-черзі» перебираючи частоти з певним кроком.
2-вимірний ЯМР
COSY
Твердофазний ЯМР
Застосовують для аналізу нерозчинних речовин та структури в твердому стані. Внаслідок відсутності усереднення сигналу завдяки обертанню молекули в розчині дає набагато складніші для аналізу дані. Важчий для запису. Для зменшення ширини ліній зразок доводиться швидко обертати (тисячі об/с). Використання сигналу протонів сильно утруднене. В останній час набув широкого застосування для аналізу трьохвимірної структури мембранних протеїнів, що не адекватно представляються розчинними моделями (в цьому випадку потрібне повне мічення 13С та 15N).
ЯМР протеїнів
ЯМР-спектроскопія білків потребує особливого підходу оскільки їх молекули містять зазвичай тисячі атомів і «рознесення сигналів» є непростою задачею. Для протеїнів розміром порядку 200 амінокислот застосовують:
- ізотопно збагачені зразки (N15, C13)
- кількаденні експерименти для накопичення сигналів
- хороші спектрометри (500 МГц та вище)
- багатовимірні техніки, що дозволяють розрізнити пари взаємодіючих (просторово близьких) ядер. Найкращі результати дає 3D-NMR CHN (використовують перенесення збудження з протонів на вуглець та азот)
Практичні аспекти


Приготування зразків для рідкофазного ЯМР аналізу
Для дослідження методом рідкофазного ЯМР, зразок розчиняють у дейтерованому розчиннику з додаванням невеликої кількості стандарту для калібрування спектру (проте спектр часто можна відкалібрувати по залишкових протонних сигналах розчинника). Основна мета використання дейтерованих розчинників — це запобігання перекриттю сигналів від розчинника із сигналами від досліджуваної речовини, проте сучасні спектрометри також використовують сигнали 2D для так званого локу (field frequency lock). Типова маса зразка для 1H ЯМР — 1-10 мг, для 13С ЯМР — 10-50 мг. Типовий об'єм розчинника — 0,5-0,7 мл. Для запису спектру на спектрометрах від компанії Bruker, мінімальній рівень розчину в ЯМР кюветі повинен бути 4 см.
Приготування зразків для твердофазного ЯМР аналізу
Для дослідження методом твердофазного ЯМР, зразок подрібнюють та розтирають у ступці до однорідного порошку. Розтертий зразок поміщають у так званий керамічний ротор (зазвичай виготовлений з цирконій оксиду). Ротор зверху тісно закривають пластиковою кришечкою, яка має форму лопатей. Ротор і кришечка сконструйовані таким чином, щоб забезпечити обертання (навколо власної осі) досліджуваного зразка з великою частотою. Типова частота обертання зразка становить 5-50 тисяч обертів на секунду. На практиці використовують ротори різного діаметру; типові діаметри роторів від компанії Bruker є 2,5 мм, 3,2 мм та 4 мм. Для досягнення вищої частоти обертання зразка використовують ротори з меншим діаметром.
Дезекранування
В ЯМР-спектроскопії — вплив електронної оболонки спостережуваного та сусідніх з ним ядер на зовнішнє магнітне поле, який полягає в його послабленні. Зовнішнє магнітне поле індукує циркуляції в електронній хмарці. Результуючий магнітний момент є зорієнтованим проти зовнішнього поля, так що локальне поле на центральному атомі послаблюється, а хімічні зсуви набирають вищих значень.
Див. також
Примітки
- Hore, P. J. (1995). Nuclear magnetic resonance. Oxford: Oxford University Press. ISBN 0-19-855682-9. OCLC 31710445.
- Claridge, Timothy D. W. (2009). High-resolution NMR techniques in organic chemistry (вид. 2nd ed). Amsterdam: Elsevier. ISBN 978-0-08-054628-5. OCLC 370435557.
Книги
Англійською
- Hore, P. J. Nuclear magnetic resonance. — Oxford : Oxford University Press, 1995. — ISBN 0-19-855682-9.
- Keeler, James. Understanding NMR spectroscopy. — 2. — Chichester, U.K. : John Wiley and Sons, 2010. — ISBN 978-0-470-74609-7.
- Claridge, Timothy D. W. High-resolution NMR techniques in organic chemistry. — 2. — Amsterdam : Elsevier, 2009. — ISBN 978-0-08-054628-5.
- Levitt, Malcolm H. Spin dynamics : basics of nuclear magnetic resonance. — 2. — Chichester, England, 2009. — ISBN 978-0-470-51118-3.
Українською
Посилання
- Protein NMR- A Practical Guide Practical guide to NMR, in particular protein NMR assignment
- James Keeler. Understanding NMR Spectroscopy (reprinted at University of Cambridge). University of California, Irvine. Архів оригіналу за 30 червня 2013. Процитовано 11 травня 2007.
- The Basics of NMR — A non-technical overview of NMR theory, equipment, and techniques by Dr. Joseph Hornak, Professor of Chemistry at RIT
- NMRWiki.ORG project, a Wiki dedicated to NMR, MRI, and EPR.
- NMR spectroscopy for organic chemistry
- The Spectral Game NMR spectroscopy game.
