Імуноглобуліни класу M
Імуноглобуліни класу M (IgM) — один із декількох ізотипів антитіл (також відомих як імуноглобуліни), які виробляються хребетними. IgM є найбільшим антитілом, і це перше антитіло, яке з'являється у відповідь на початковий вплив антигену.[1][2] У випадку з людьми та іншими ссавцями, які досліджувались, селезінка, де знаходяться плазмобласти, що відповідають за вироблення антитіл, є головним місцем специфічного вироблення IgM.[3][4]
Історія
Дослідження IgM розпочалося з повідомлення у 1937 році про те, що коні, гіперімунізовані полісахаридом пневмокока, виробляли антитіла, які були набагато більшими, ніж типовий γ-глобулін кролика,[5] з молекулярною масою 990 000 дальтонів.[6] З огляду на його великі розміри, нове антитіло спочатку називалось γ-макроглобуліном, а потім у подальшій термінології як IgM, де «M» — «макро». V-домени нормального імуноглобуліну дуже гетерогенні, що відображає їхню роль у захисті від великої різноманітності інфекційних мікробів, і ця неоднорідність ускладнювала детальний структурний аналіз IgM. Згодом було виявлено два джерела гомогенного IgM. Високомолекулярний білок, що виробляється деякими хворими на мієломну хворобу, був визнаний γ-макроглобуліном, що виробляється пухлиною, і стало зрозуміло, що оскільки пухлина є клоном, то IgM, який вона виробляє, однорідний.[7] У 1960-х роках були розроблені методи індукування пухлин у мишей, що продукують імуноглобулін (плазмацитоми), забезпечуючи тим самим джерело однорідних імуноглобулінів різних ізотипів, включаючи IgM.[8] Зовсім нещодавно було встановлено, що експресія модифікованих генів імуноглобуліну в культурі тканин може бути використана для отримання IgM із певним чергуваннями і, таким чином, для визначення молекулярних вимог до особливостей отримуваного імнуноглобуліну.
Структура
Імуноглобуліни поєднують легкі та важкі ланцюги. Легкий ланцюг (λ або κ) являє собою білок зі ~220 амінокислот, що складається з варіабельного домену VL (сегмент приблизно 110 амінокислот) і константного домену CL (також довжиною приблизно 110 амінокислот). Важкий ланцюг µ IgM являє собою білок ~576 амінокислот і включає змінний домен (VH ~110 амінокислот), чотири різні домени константної ділянки (Cµ1, Cµ2, Cµ3, Cµ4, кожен ~110 амінокислот) та «хвіст» з ~20 амінокислот. Важкий ланцюг µ містить олігосахариди з п'ятьма залишками аспарагіну. Олігосахариди на IgM мишей та людей частково характеризуються різноманітними методами, включаючи NMR, зв'язування лектину, різні хроматографічні системи та ферментативну чутливість.[9] Структура олігосахаридів на кожній ділянці відрізняється в деталях, а переважаючі олігосахариди — біантенарні, трикутні, високоманозні — відрізняються між ділянками.
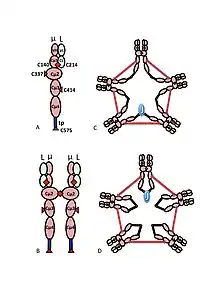
A) Гетеродимер µL, який іноді називають півмером, із змінними (VH, VL) та доменами константних ділянок (Cµ1, Cµ2, Cµ3, Cµ4tp; CL). Цистеїни, що опосередковують дисульфідні зв'язки між µ-ланцюгами, показані у вигляді червоних наконечників стрілок, так що дисульфідний зв'язок цистеїну виглядає у вигляді червоних ромбів.
B) «Мономер» IgM (µL)2. Дисульфідні зв'язки між доменами Cµ2 позначені червоним ромбом.
C, D) Дві моделі пентамера IgM, що містять J-ланцюг, які в різні періоди з'являлись у різних публікаціях. Як і у (B), дисульфідні зв'язки між доменами Cµ2 і дисульфідні зв'язки між доменами Cµ4tp позначені червоними ромбами; дисульфідні зв'язки Cµ3 представлені (для наочності) довгими чепрвоними стрілками. Зв'язок, тобто міжланцюговий дисульфідний зв'язок µ-ланцюгів, позначається як електричний зв'язок. У (C) дисульфідні зв'язки Cµ3 приєднуються до µ-ланцюгів паралельно до дисульфідних зв'язків Cµ4tp, і ці дисульфідні зв'язки приєднуються до µ-ланцюгів послідовно з дисульфідними зв'язками Cµ2. У (D) дисульфідні зв'язки Cµ2 та Cµ4tp приєднуються до µ-ланцюгів паралельно, і обидва типи приєднуються до µ-ланцюгів послідовно з дисульфідними зв'язками Cµ3.[10].
Мультимерна структура IgM схематично показана на Рисунку 1. На Рисунку 1А показаний «гетеродимер», що складається з одного легкого ланцюга, позначеного L, і одного важкого ланцюга, позначеного µ. Важкий і легкий ланцюги утримуються разом як за допомогою дисульфідних зв'язків (зображених у вигляді червоних трикутників), так і за допомогою нековалентних взаємодій.
Рисунок 1B показує дві частини µL, пов'язані дисульфідним зв'язком у доменах Cµ2; цю структуру (µL)2 часто називають «мономером IgM», оскільки вона в деякому відношенні є аналогом структурі імуноглобуліну G (IgG).
На основі його швидкості седиментації та появи на електронних мікрофотографіях було зроблено висновок, що IgM в основному є «пентамером», тобто полімером, що складається з п'яти «мономерів» [(µL)2]5, і спочатку був зображений на моделях на Рисунках 1С та 1D, з дисульфідними зв'язками між доменами Cµ3 та між хвостовими частинами.[11][12] Також показано, що пентамерний IgM включає третій білок, J-ланцюг. J-ланцюг («J» — від англ. joining — «з'єднання») виявлено як ковалентно пов'язаний компонент полімерних IgA та IgM.[13][14] J-ланцюг — це невеликий (~137 амінокислот), кислий білок.[15]
Молекулярні вимоги до формування полімерного IgM
Спочатку очікувалося, що J-ланцюг буде важливим для утворення полімерних імуноглобулінів, і справді полімеризація IgA сильно залежить (але не абсолютно) від J-ланцюга.[16][17] На відміну від цього, полімерний IgM ефективно утворюється за відсутності J-ланцюга.[18][19]
Переважною формою IgM людини та миші є пентамер. Для порівняння, IgM шпоркової жаби — це переважно гексамер,[20][21] IgM кісткових риб — переважно тетрамер, а IgM хрящових риб (акули) — переважно пентамер.[22][23] Незважаючи на переважання пентамеру серед IgM мишей та людей, було очевидно, що ці IgM також можуть існувати як гексамер.[24][25] Подальші дослідження з використанням рекомбінантних систем експресії ДНК показали, що гексамер є основною формою IgM мишей, коли IgM виробляється в умовах, в яких запобігається включенню J-ланцюга, або вироблення IgM у клітинах, у яких відсутні J-ланцюги,[18] або продукуванням IgM з важким µ-ланцюгом, в якому бракує цистеїну в хвостовій частині.[26][27] Таким чином, гексамерний IgM ніколи не містить J-ланцюга; пентамерний IgM може бути утворений таким чином, щоб включати або не включати J-ланцюг.[28]
Важливою відмінністю між важкими µ- та γ-ланцюгами є доступність цистеїнів для утворення дисульфідних зв'язків між важкими ланцюгами. У разі важкого γ-ланцюга єдині між-γ-зв'язки утворюються цистеїнами в шарнірі, і відповідно кожен γ-ланцюг зв'язується лише з одним γ-ланцюгом. На відміну від цього, домени Cµ2 та Cµ3 та хвостова частина містять цистеїн, який утворює дисульфідний зв'язок з іншим µ-ланцюгом. Цистеїни в доменах Cµ2 опосередковується утворенням мономерного IgM (µL)2. Хвостова частина разом із включеним цистеїном необхідна і достатня для утворення полімерних імуноглобулінів. Тобто, видалення хвостової частини з важкого µ-ланцюга запобігає утворенню полімерного IgM.[29] І навпаки, клітини, що експресують γ важкий ланцюг, який був модифікований, щоб включати хвостову частину, виробляють полімерний IgG.[30][31][32]
Роль цистеїну в домені Cµ3 є більш тонкою. Рисунки 1С і 1D зображаючть можливі моделі для пентамерного IgM. У цих моделях передбачається, що кожен µ-ланцюг пов'язуватиме два інших µ-ланцюги. Однак жодна з моделей не може повністю врахувати структуру полімерного IgM. Наприклад, модель на Рисунку 1С передбачає, що дисульфідний зв'язок між доменами Cµ2 є важливим для отримання дисульфідно-зв'язаного полімерного IgM. Модель на Рисунку 1D передбачає, що дисульфідний зв'язок між доменами Cµ3 є суттєвим. Насправді дисульфідний полімерний IgM все ще може бути виробленим, якщо якийсь із трьох цистеїнів відсутній. У контексті моделей, в яких кожен µ-ланцюг взаємодіє лише з двома іншими µ-ланцюгами, ці результати дозволяють припустити, що деякі молекули схожі на Рисунок 1С, а деякі як Рисунок 1D. Однак наявність трьох цистеїнів для зв'язків між µ-ланцюгами свідчить про те, що µ-ланцюги можуть зв'язувати три інші µ-ланцюги, як показано на Рисунку 2. У тому ж дусі на Рисунку 2С представлена модель для пентамера, що містить J-ланцюг, яка демонструє, що J-ланцюг приєднується до µ-ланцюгів, які не приєднуються до інших µ-ланцюгів цистеїнами в доменах Cµ3.[27][33]
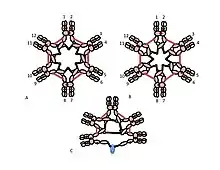
A, B) Ці Рисунки демонструють дві з багатьох можливих моделей дисульфідного зв'язку між µ-ланцюгами в гексамерному IgM. На Рисунку 1 дисульфідні зв'язки Cµ2 та дисульфідні зв'язки Cµ4tp позначені червоними ромбами, а дисульфідні зв'язки Cµ3 — довгими червоними стрілками. В обох моделях A і B кожен тип дисульфідного зв'язку (Cµ2-Cµ2; Cµ3-Cµ3; Cµ4tp-Cµ4tp) з'єднує µ-ланцюги послідовно з кожним наступним.
C) Це зображення пентамерного IgM ілюструє, як J-ланцюг може бути зв'язаний з µ-ланцюгами, які не зв'язані дисульфідними зв'язками Cµ3
Пентамерний IgM зазвичай представляється як такий, що містить один J-ланцюг на полімер, але насправді виміри стехіометрії J-ланцюга коливаються від однієї J-молекули на полімер до трьох J-молекул на полімер.[34][35][36][37] Широкий діапазон може бути обумовлений технічними проблемами, такими як неповне радіомаркування або неточне визначення лінії Оухтерлоні. Однак варіація також може бути обумовлена неоднорідністю препаратів IgM, тобто різні препарати могли суттєво відрізнятися за своїм вмістом J-наявних та J-дефіцитних полімерів.
Третинна і четвертинна структура µ-константної ділянки
Щоб отримати уявлення про детальну тривимірну структуру µ-ланцюга, окремі домени Cµ2, Cµ3 та Cµ4tp окремо продукували в кишковій паличці, а потім аналізували різними методами, включаючи швидкість осідання, рентгенівську кристалографію та NMR-спектроскопію. Як і у випадку з іншими імуноглобулінами, домени важкого µ-ланцюга мають характерні поверхневі β-листи, що містять сім ланцюгів, стабілізованих внутрішньодоменними дисульфідними зв'язками. Загалом, константна ділянка IgM має «грибоподібну» структуру, де домени Cµ2-Cµ3 є диском, аналогічним голівці гриба, а домени Cµ4tp виступають, як коротке стебло.[38]
Функція
IgM взаємодіє з кількома іншими фізіологічними молекулами:
- IgM може зв'язувати компонент комплементу С1 і активувати класичний шлях, що призводить до опсонізації антигенів та цитолізу.
- IgM зв'язується з рецептором поліімуноглобуліну (pIgR) у процесі, підчас якого IgM спрямовуються на поверхню слизової оболонки, такі як просвіт кишечника, та в грудне молоко. Це зв'язування залежить від J-ланцюга.[39]
- Виявлено ще два рецептори Fc, які зв'язують IgM—Fcα/µ-R та Fcµ-R. Fcα/µ-R, подібно до pIgR, пов'язує полімерні IgM та IgA. Fcα/µ-R може опосередковувати ендоцитоз, і його експресія в кишечнику свідчить про роль у імунітеті слизової. Fcµ-R (раніше відомий як Toso/Faim3) зв'язує виключно IgM і може опосередковувати клітинне поглинання кон'югованого IgM-антигену.[40] Інактивація відповідних генів у мишей виробляє фенотип, але фізіологічні функції цих рецепторів досі невизначені[41]
Регуляція імунної відповіді
Специфічні імуноглобуліни, які вводяться тваринам разом з їх антигеном, можуть впливати на реакцію антитіл на цей самий антиген.[42] Ендогенні антитіла, що утворюються після первинної імунізації, також можуть впливати на реакцію антитіл на прискорювальну імунізацію, припускаючи, що подібні ефекти виникають під час фізіологічних станів. «Нормативні» ефекти можуть бути як позитивними, так і негативними. Тобто, залежно від типу антигену та ізотипу антитіла, ефектом може бути придушення або посилення реакції антитіла. Такі ефекти добре проілюстровані експериментами, що включають імунізацію ксеногенними (чужорідними) еритроцитами (червонокрівцями). Наприклад, коли IgG вводять разом з ксеногенними еритроцитами, ця комбінація викликає майже повне придушення відповіді на антитіла, специфічні для еритроцитів. Цей ефект клінічно використовується для запобігання імунізації еритроцитів резус-позитивних плодів від резус-негативних матерів, і його застосування різко зменшило частоту гемолітичної хвороби новонародженого.[43] На відміну від ефекту IgG, антиген-специфічний IgM може значно посилити реакцію антитіл, особливо у випадку великих антигенів.[44] Таким чином, коли IgM, специфічний для еритроцитів, вводиться тваринам (включаючи людину) разом з еритроцитами, індукується набагато сильніша реакція антитіл на еритроцити, ніж при введенні еритроцитів окремо.
Низка доказів вказують на те, що здатність IgM активувати комплемент необхідна для посилення його ефекту. Тобто, опосередковане IgM посилення не спостерігається ні у тварин, у яких виснажений компонент комплементу С3, ні у тварин-мутантів, у яких відсутні рецептори комплементу 1 і 2. Подібним чином мутований IgM, який не може активувати комплемент, не посилює імунну відповідь.
Можливим поясненням опосередкованого IgM посилення є те, що В-лімфоцити захоплюють комплекси IgM-антиген-комплементу і транспортують комплекси в ділянки селезінки, де генеруються ефективні імунні відповіді. Оскільки IgM продукується на початку імунної відповіді, і може бути важливим для ініціювання реакцій антитіл.
Синтез
У клітинах зародкової лінії (сперматозоїди та яйцеклітини) гени, які з часом кодують імуноглобуліни, не мають функціональної форми (див. V(D)J-рекомбінація). У випадку важкого ланцюга три сегменти зародкової лінії, позначені V, D і J, лігують разом і приєднують до ДНК, що кодує константну область важкого µ-ланцюга. На початку онтогенезу В-клітини експресують важкі як µ- так і δ-ланцюги; коекспресія цих двох важких ланцюгів, кожна з яких має один і той же V-домен, залежить від альтернативного сплайсингу та альтернативних додавання полі-А ділянок. На експресію інших ізотипів (γ, ε та α) впливає інший тип перебудови ДНК, процес, який називається перемиканням класу імуноглобулінів.[45]
Клінічне значення
IgM є першим імуноглобуліном, що експресується у плоді людини (приблизно з 20-го тижня),[46] і філогенетично найдавнішим антитілом, що розвивається.[47]
Антитіла IgM з'являються на початку перебігу інфекції і, як правило, з'являються меншою мірою після подальшого впливу. Антитіла IgM не проникають через плаценту людини (лише ізотип IgG).
Ці дві біологічні властивості IgM роблять його корисним для діагностики інфекційних захворювань. Виявлення антитіл IgM у сироватці крові пацієнта вказує на недавнє зараження, а в сироватці новонародженого — на внутрішньоутробну інфекцію (наприклад, синдром вродженої краснухи).
Розвиток антидонорного IgM після трансплантації органів не пов'язаний з відторгненням трансплантата, але він може мати захисний ефект.[48]
Часто виявляється, що IgM у нормальній сироватці крові зв'язується зі специфічними антигенами, навіть за відсутності попередньої імунізації.[49] З цієї причини IgM іноді називали «природним антитілом». Це явище, ймовірно, пов'язане з високою активністю IgM, що дозволяє йому помітно зв'язуватися навіть із слабо перехресно реагуючими антигенами, які зустрічаються в природі. Наприклад, антитіла IgM, які зв'язуються з антигенами А і В еритроцитів, можуть утворюватися в ранньому віці в результаті впливу А- і В-подібних речовин, які присутні на бактеріях або, можливо, також на рослинних матеріалах.
Антитіла IgM в основному відповідають за скупчення (аглютинацію) еритроцитів, якщо реципієнт переливання крові отримує кров, несумісну з їх групою крові.
Мутація mu-ланцюга викликає аутосомно-рецесивну агаммаглобулінемію.[50]
Див. також
- Імунодефіцит з гіперімуноглобуліном М
- Ізольований дефіцит первинного імуноглобуліну М
- Імунна відповідь
Примітки
- Immunoglobulin M. The American Heritage Dictionary of the English Language (вид. Fourth). Houghton Mifflin Company. 2004. ISBN 978-0618082308.
- Alberts, B.; Johnson, A.; Lewis, J.; Walter, P.; Raff, M.; Roberts, K. (2002). Chapter 24. Molecular Biology of the Cell (вид. 4th). Routledge. ISBN 978-0-8153-3288-6.
- Capolunghi, F.; Rosado, M. M.; Sinibaldi, M.; Aranburu, A.; Carsetti, R. (2013). Why do we need IgM memory B cells?. Immunology Letters 152 (2): 114–20. PMID 23660557. doi:10.1016/j.imlet.2013.04.007.
- Williams, N.; O'Connell, P. R. (2008). Chapter 62. Bailey & Love's Short Practice of Surgery (вид. 25th). CRC Press. с. 1102. ISBN 9780340939321.
- Heidelberger, M.; Pedersen, K. O. (1937). The molecular weight of antibodies. Journal of Experimental Medicine 65 (3): 393–414. PMC 2133497. PMID 19870608. doi:10.1084/jem.65.3.393.
- Kabat, E. A. (1939). The molecular weight of antibodies. Journal of Experimental Medicine 69 (1): 103–118. PMC 2133729. PMID 19870830. doi:10.1084/jem.69.1.103.
- Waldenström, J. (1943). Incipient myelomatisis or "essential" hyoerglobulinemis with fibrinogenopenia—a new syndrome?. Acta Medica Scandinavica 142 (3–4): 216–247. doi:10.1111/j.0954-6820.1944.tb03955.x.
- Potter, M. (2007). The early history of plasma cell tumors in mice, 1954-1976. Advances in Cancer Research 98. с. 17–51. ISBN 9780123738967. PMID 17433907. doi:10.1016/S0065-230X(06)98002-6.
- Monica, T. J.; Williams, S. B.; Goochee, C. F.; Maiorella, B. L. (1995). Characterization of the glycosylation of a human IgM produced by a human-mouse hybridoma. Glycobiology 5 (2): 175–185. PMID 7780192. doi:10.1093/glycob/5.2.175.
- Heyman, B.; Shulman, M. J. (2016). Structure, Function, and Production of Immunoglobulin M (IgM). У Ratcliffe, M. Encyclopedia of Immunobiology 2. Elsevier. с. 1–14. ISBN 978-0-12-374279-7. doi:10.1016/B978-0-12-374279-7.05001-3.
- Beale, D.; Feinstein, A. (1969). Studies on the Reduction of a Human 19S Immunoglobulin M. Biochemical Journal 112 (2): 187–194. PMC 1187691. PMID 4979347. doi:10.1042/bj1120187.
- Milstein, C.P. (1975). Interchain disulfide bridges of mouse Immunoglobulin M. Biochemical Journal 151 (3): 615–624. PMC 1172409. PMID 766753. doi:10.1042/bj1510615.
- Halpern, M. S.; Koshland, M. E. (1970). Novel subunit of secretory IgA. Nature 228 (5278): 1276–1278. Bibcode:1970Natur.228.1276H. PMID 5530654. doi:10.1038/2281276a0.
- Mestecky, J.; Zikin, J.; Butler, W. T. (1971). Immunoglobulin M an secretory immunoglobulin A: presence of common polypeptide chain different from light chains. Science 171 (3976): 1163–1165. Bibcode:1971Sci...171.1163M. PMID 5544873. doi:10.1126/science.171.3976.1163.
- Frutiger, S. (1992). Disulfide bond assignment in human J chain and its covalent pairing with immunoglobulin M. Biochemistry 31 (50): 12643–12647. PMID 1472500. doi:10.1021/bi00165a014.
- Johansen, F. E.; Braathen, R.; Brandtzaeg, P. (2000). Role of J chain in secretory immunoglobulin formation. Scandinavian Journal of Immunology 52 (3): 240–8. PMID 10972899. doi:10.1046/j.1365-3083.2000.00790.x.
- Sørensen, V. (2000). Structural requirements for incorporation of J chain into human IgM and IgA. International Immunology 12 (1): 19–27. PMID 10607746. doi:10.1093/intimm/12.1.19.
- Cattaneo, A.; Neuberger, M. S. (1987). Polymeric immunoglobulin M is secreted by transfectants of non-lymphoid cells in the absence of immunoglobulin J chain. The EMBO Journal 6 (9): 2753–2758. PMC 553699. PMID 3119328. doi:10.1002/j.1460-2075.1987.tb02569.x.
- Fazel, S.; Wiersma, E. J.; Shulman, M. J. (1997). Interplay of J chain and disulfide bonding in assembly of polymeric IgM. International Immunology 9 (8): 1149–1158. PMID 9263012. doi:10.1093/intimm/9.8.1149.
- Parkhouse, R.; Askonas, B. A.; Dourmashkin, R. R. (1970). Electron microscopic studies of mouse immunoglobulin M; structure and reconstitution following reduction. Immunology 18 (4): 575–584. PMC 1455497. PMID 5421036.
- Schwager, J.; Hadji-Azlmi, I. (1984). Mitogen-induced B-cell differentiation in Xenopus laevis. Differentiation 27 (3): 182–188. PMID 6334001. doi:10.1111/j.1432-0436.1984.tb01426.x.
- Fillatreau, S. (2013). The astonishing diversity of Ig classes and B cell repertoires in teleost fish. Frontiers in Immunology 4: 1–14. PMC 3570791. PMID 23408183. doi:10.3389/fimmu.2013.00028.
- Getahun, A. (1999). Influence of the μ-chain C-terminal sequence on polymerization of immunoglobulin M. Immunology 97 (3): 408–413. PMC 2326861. PMID 10447761. doi:10.1046/j.1365-2567.1999.00797.x.
- Dolder, F. (1971). Occurrence, Isolation and Interchain Bridges of Natural 7-S Immunoglobulin M in Human Serum. Biochimica et Biophysica Acta 236 (3): 675–685. PMID 4997811.
- Eskeland, T.; Christensen, T. B. (1975). IgM molecules with and without J chain in serum and after purification, studied by ultracentrifugation, electrophoresis, and electron microsopy. Scandinavian Journal of Immunology 4 (3): 217–228. PMID 807966. doi:10.1111/j.1365-3083.1975.tb02620.x.
- Davis, A. C.; Roux, K. H.; Shulman, M. J. (1988). On the structure of polymeric IgM. European Journal of Immunology 18 (7): 1001–1008. PMID 3136022. doi:10.1002/eji.1830180705.
- Davis, A. C. (1989). Intermolecular disulfide bonding in IgM: effects of replacing cysteine residues in the µ heavy chain. The EMBO Journal 8 (9): 2519–2526. PMC 401247. PMID 2511005. doi:10.1002/j.1460-2075.1989.tb08389.x.
- Collins, C.; Tsui, F. W.; Shulman, M. J. (2002). Differential activation of human and guinea pig complement by pentameric and hexameric IgM. European Journal of Immunology 32 (6): 1802–1810. PMID 12115664. doi:10.1002/1521-4141(200206)32:6<1802::AID-IMMU1802>3.0.CO;2-C.
- Davis, A. C. (1989). Mutations of the mouse m H chain which prevent polymer assembly. Journal of Immunology 43 (4): 1352–1357. PMID 2501393.
- Smith, R. I. F.; Coloma, M. J.; Morrison, S. L. (1995). Addition of a mu-tailpiece to IgG results in polymeric antibodies with enhanced effector functions including complement-mediated cytolysis by IgG4. Journal of Immunology 154 (5): 2226–2236. PMID 7868896.
- Sørensen, V. (1996). Effect of the IgM and IgA secretory tailpieces on polymerization and secretion of IgM and IgG. Journal of Immunology 156 (8): 2858–2865. PMID 8609405.
- Smith, R.; Morrison, S. L. (1994). Recombinant polymeric IgG: An approach to engineering more potent antibodies. Nature Biotechnology 12 (7): 683–688. PMID 7764912. doi:10.1038/nbt0794-683.
- Wiersma, E. J.; Shulman, M. J. (1995). Assembly of IgM: role of disulfide bonding and noncovalent interactions. Journal of Immunology 154 (10): 5265–5272. PMID 7730630.
- Chapuis, R. M.; Koshland, M. E. (1974). Mechanism of IgM polymerization. Proc. Natl. Acad. Sci. U.S.A. 71 (3): 657–661. Bibcode:1974PNAS...71..657C. PMC 388071. PMID 4207070. doi:10.1073/pnas.71.3.657.
- Mihaesco, C.; Mihaesco, E.; Metzger, H. (1973). Variable J-chain content in human IgM. FEBS Letters 37 (2): 303–306. PMID 4202824. doi:10.1016/0014-5793(73)80483-1.
- Brandtzaeg, P. (1976). Complex formation between secretory component and human immunoglobulin related to their content of J chain. Scandinavian Journal of Immunology 5 (4): 411–419. PMID 821140. doi:10.1111/j.1365-3083.1976.tb00295.x.
- Grubb, A. O. (1978). Quantitation of J chain in human biological fluids by a simple immunochemical procedure. Acta Medica Scandinavica 204 (1–6): 453–465. PMID 104551. doi:10.1111/j.0954-6820.1978.tb08473.x.
- Müller, R. (2013). High-resolutiion structures of the IgM Fc domainsreveal principles of its hexamer formation. Proc. Natl. Acad. Sci. U.S.A. 110 (25): 10183–10188. Bibcode:2013PNAS..11010183M. PMC 3690842. PMID 23733956. doi:10.1073/pnas.1300547110.
- Johansen, F. E.; Braathen, R.; Brandtzaeg, P. (2000). Role of J chain in secretory immunoglobulin formation. Scandinavian Journal of Immunology 52 (3): 240–8. PMID 10972899. doi:10.1046/j.1365-3083.2000.00790.x.
- Shima, H. (2010). Identification of TOSO/FAIM3 as an Fc receptor for IgM. Int. Immunol. 22 (3): 149–56. PMID 20042454. doi:10.1093/intimm/dxp121.
- Ouchida, R. (2012). Critical role of the IgM Fc receptor in IgM homeostasis, B-cell survival, and humoral immune responses. Proc. Natl. Acad. Sci. U.S.A. 109 (40): E2699–706. Bibcode:2012PNAS..109E2699O. PMC 3479561. PMID 22988094. doi:10.1073/pnas.1210706109.
- Heyman, B (2013). Antibody mediated regulation of humoral immunity. in Nimmerjahn, F. (ed.) Molecular and cellular mechanisms of antibody activity: Springer.
- Urbaniak, S. J. & Greiss, M. A. (2000). RhD haemolytic disease of the fetus and the newborn. Blood Rev. 14 (1): 33–61. PMID 10805260. doi:10.1054/blre.1999.0123.
- Sörman A, Zhang L, Ding Z, Heyman, B. (2014). How antibodies use complement to regulate antibody responses. Mol. Immunol. 61 (2): 79–88. PMID 25001046. doi:10.1016/j.molimm.2014.06.010.
- Murphy, K.; Weaver, C. (2016). Janeway's Immunobiology. New York, NY: Garland Science/Taylor and Francis. с. 195. ISBN 9780815345053.
- van Furth, R.; Schuit, H. R.; Hijmans, W. (1965). The immunological development of the human fetus. Journal of Experimental Medicine 122 (6): 1173–88. PMC 2138097. PMID 4159036. doi:10.1084/jem.122.6.1173.
- Review of Medical Physiology by Вільям Френсіс Ґанонґ
- McAlister, C. C. (2004). Protective anti-donor IgM production after crossmatch positive liver-kidney transplantation. Liver Transplantation 10 (2): 315–9. PMID 14762873. doi:10.1002/lt.20062.
- Jayasekera, J. P.; Moseman, E. A.; Carroll, M. C. (2007). Natural antibody and complement mediate neutralization of influenza virus in the absence of prior immunity. Journal of Virology 81 (7): 3487–94. PMC 1866020. PMID 17202212. doi:10.1128/JVI.02128-06.
- OMIM Entry - # 601495 - AGAMMAGLOBULINEMIA 1, AUTOSOMAL RECESSIVE; AGM1. omim.org. Процитовано 25 березня 2021.
Посилання
| Класифікація |
|---|
- MeSH Immunoglobulin+M
- Immunoglobulin M Deficiency Reference from Medscape.com