Іржа
Іржа, рідше иржа[1], ржа[2] є загальним терміном для визначення оксидів заліза. У розмовній мові цей термін застосовується до червоних оксидів, що утворюються в результаті реакції заліза з киснем в присутності води або вологого повітря. Є й інші форми іржі, наприклад, продукт, що утворюється в результат реакції заліза з хлором за відсутності кисню. Така речовина утворюється, зокрема, в арматурі, використовуваної в підводних бетонних стовпах, і називають її зеленою іржею. Кілька видів корозії помітні візуально або за допомогою спектроскопії. Вони формуються при різних зовнішніх умовах.[3] Іржа складається з гідратованого оксиду заліза (III) Fe2O3·nH2O і метагідроксиду заліза (FeO(OH), Fe(OH)3). При наявності кисню та води і достатньому часу будь-яка маса заліза в кінцевому підсумку перетворюється повністю в іржу і руйнується. Поверхня іржі не створює захисту для нижнього шару заліза, на відміну від утворення патини на мідній поверхні.
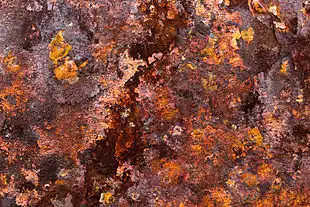

Іржею як правило називають продукт корозії тільки заліза і його сплавів, таких як сталь. Багато інших металів теж піддаються корозії, але їх оксиди зазвичай не називають іржею.
Хімічні реакції

Причини іржавіння
Якщо залізо, що містить які-небудь добавки та домішки (наприклад, чавун) знаходиться в контакті з водою, киснем або іншим сильним окиснювачем і / або кислотою, то воно починає іржавіти. Якщо при цьому присутня сіль, наприклад, є контакт з солоною водою, корозія відбувається швидше в результаті електрохімічних реакцій. Чисте залізо стійке до дії чистої води і сухого кисню. Як і в інших металів, наприклад, в алюмінію, щільне оксидне покриття на залізі (шар пасивації) захищає основну масу заліза від подальшого окиснення. Перетворення ж пасивального шару оксиду заліза в іржу є результатом комбінованої дії двох агентів, як правило, кисню і води. Іншими руйнівними чинниками є діоксид сірки та вуглекислий газ у воді. У цих агресивних умовах утворюються різні види гідроксиду заліза. На відміну від оксидів заліза, гідроксиди не захищають основну масу металу. Оскільки гідроксид формується і відшаровується від поверхні, впливу піддається наступний шар заліза, і процес корозії триває до тих пір, поки все залізо не буде знищене, або в системі закінчиться весь кисень, вода, діоксид вуглецю або діоксид сірки.[4]
Протікання хімічних реакцій
Іржавіння заліза - це електрохімічний процес, який починається з перенесення електронів від заліза до кисню.[5] Швидкість корозії залежить від кількості наявної води, і прискорюється електролітами, про що свідчать наслідки застосування дорожньої солі на корозію автомобілів. Ключовою реакцією є відновлення кисню:
- O2 + 4 e− + 2 H2O → 4 OH−
Оскільки при цьому утворюються гідроксид-іони, цей процес сильно залежить від присутності кислоти. Дійсно, корозія більшості металів киснем прискорюється при зниженні рН. Забезпечення електронів для вищенаведеної реакції відбувається при окисненні заліза, яке може бути описане наступним чином:
- Fe → Fe2+ + 2 e−
Наступна окиснювально-відновна реакція відбувається в присутності води і має вирішальне значення для формування іржі:
- 4 Fe2+ + O2 → 4 Fe3+ + 2 O2−
Крім того, такі багатоступінчасті кислотно-лужні реакції впливають на хід формування іржі:
- Fe2+ + 2 H2O ⇌ Fe(OH)2 + 2 H+
- Fe3+ + 3 H2O ⇌ Fe(OH)3 + 3 H+
що призводить до таких реакцій підтримки балансу дегідратації:
- Fe(OH)2 ⇌ FeO + H2O
- Fe(OH)3 ⇌ FeO(OH) + H2O
- 2 FeO(OH) ⇌ Fe2O3 + H2O
З наведених вище рівнянь видно, що формування продуктів корозії обумовлено наявністю води і кисню. З обмеженням розчиненого кисню на передній план висуваються залізо (II), що містять матеріали, в тому числі FeO і чорний магніт (Fe3O4). Висока концентрація кисню сприятлива для матеріалів з тривалентного заліза, з номінальною формулою Fe(OH)3-xOx/2. Характер корозії змінюється з часом, відображаючи повільні швидкості реакцій твердих тіл.
Крім того, ці складні процеси залежать від присутності інших іонів, таких як Ca2+, які слугують електролітом, і таким чином, прискорюють утворення іржі, або в поєднанні з гідроксидами та оксидами заліза утворюють різні осади виду Ca-Fe-O-OH.
Більш того, колір іржі можна використовувати для перевірки наявності іонів Fe2+, які змінюють колір іржі з жовтого на синій.
Запобігання іржавіння

Іржа є проникною для повітря і води, тому внутрішні шари заліза продовжують роз'їдатися. Запобігання іржі, отже, вимагає покриття, яке виключає утворення іржі. На поверхні нержавіючої сталі формується пасивуючий шар оксиду хрому (III). Подібний прояв пасивації відбувається з магнієм титаном цинком, оксидом цинку алюмінієм, поліаніліном та іншими електропровідними полімерами.
Гальванізація
Хорошим підходом до запобігання іржі є метод гальванізації, який зазвичай полягає в нанесенні на об'єкт, що захищається шару цинку або методом гарячого цинкування, або методом гальванотехніки. Цинк традиційно використовується, тому що він досить дешевий, має гарну адгезію до сталі і забезпечує катодний захист на сталеву поверхню в разі пошкодження цинкового шару. У більш агресивних середовищах (таких, як солона вода) переважно є кадмій. Гальванізація часто не потрапляє на шви, отвори і стики, через які наносилося покриття. У цих випадках покриття забезпечує катодний захист металу, де воно виступає в ролі гальванічного анода, на який насамперед і впливає корозія. У сучасніші покриття додають алюміній, новий матеріал називається цинк-алюм. Алюміній в покритті мігрує, покриваючи подряпини і, таким чином, забезпечуючи триваліший захист. Цей метод заснований на застосуванні оксидів алюмінію та цинку, що захищають подряпини на поверхні, на відміну від процесу оксідизації, як у випадку застосування гальванічного анода. В деяких випадках при дуже агресивних середовищах або тривалих строках експлуатації застосовуються одночасно і гальванізація цинком, та інші захисні покриття, щоб забезпечити надійний захист від корозії.
Катодний захист
Катодний захист є методом, використовуваним для запобігання корозії в прихованих під землею або під водою структурах шляхом подачі електричного заряду, який пригнічує електрохімічні реакції. Якщо її правильно застосовувати, корозія може бути зупинена повністю. У своїй простій формі це досягається шляхом з'єднання об'єкта, який захищається, з протекторним анодом, в результаті чого на поверхні заліза або сталі відбувається тільки катодний процес. Протекторний анод повинен бути зроблений з металу з негативнішим електродним потенціалом, ніж залізо або сталь, звичайно це цинк, алюміній або магній.
Лакофарбові та інші захисні покриття
Від іржі можна захиститися за допомогою лакофарбових і інших захисних покриттів, які ізолюють залізо з навколишнього середовища. Великі поверхні, поділені на секції, як наприклад, корпуси суден і сучасних автомобілів, часто покривають продуктами на основі воску (технічне масло для консервації). Такі засоби обробки містять також інгібітори від корозії. Покриття сталевої арматури бетоном (залізобетон) забезпечує деякий захист сталі в середовищі з високим рН. Однак корозія сталі в бетоні все ще є проблемою.
Покриття шаром металу

- Оцинкування (оцинковане залізо / сталь): залізо або сталь покриваються шаром цинку. Може використовуватися метод гарячого цинкування або метод цинкового дуття.
- Лудіння: м'яка листова сталь покривається шаром олова.
- Хромування: тонкий шар хрому наноситься електролітичним способом на сталь, забезпечуючи як захист від корозії, так і яскравий, полірований вигляд зовнішній. Часто використовується в блискучих компонентах велосипедів, мотоциклів та автомобілів.
Воронування
Воронування - це метод, який може забезпечити обмежену стійкість до корозії для дрібних предметів із сталі, таких як вогнепальна зброя і ін. Метод полягає в отриманні на поверхні вуглецевої або низьколегованої сталі або чавуну шару оксидів заліза товщиною 1-10 мкм . Для додання блиску, а також для поліпшення захисних властивостей окисної плівки, її просочують мінеральною або рослинною олією.
Зниження вологості
Іржі можна уникнути, знижуючи вологість атмосфери. Цього можна досягти, наприклад, за допомогою силікагелю.
Інгібітори
Інгібітори корозії, як, наприклад, газоподібні або леткі інгібітори, можна використовувати для запобігання корозії в закритих системах.
Економічний ефект

Іржа викликає деградацію інструментів і конструкцій, виготовлених з матеріалів на основі заліза. Оскільки іржа має набагато більший обсяг, ніж вихідне залізо, її наріст веде до швидкого руйнування конструкції, посилюючи корозію на прилеглих до нього ділянках - явище, зване "поїданням іржею". Це явище стало причиною руйнування моста через річку Міанус (штат Коннектикут, США) в 1983 році, коли підшипники підіймального механізму повністю проржавіли зсередини. В результаті цей механізм зачепив за ріг однієї з дорожніх плит і зрушив її з опор. Іржа була також головним фактором руйнування Срібного моста в Західній Вірджинії в 1967 році, коли сталевий висячий міст впав менше, ніж за хвилину. Загинули 46 водіїв та пасажирів, що знаходилися в той час на мосту.

Міст Кінзу в штаті Пенсільванія був знесений торнадо в 2003 році в значній мірі тому, що центральні базові болти, що з'єднують конструкцію із землею, проржавіли, надавши мосту можливість триматися просто під дією сили тяжіння .
Крім того, корозія покритих бетоном сталі і заліза може викликати розколювання бетону, що створює серйозні конструкторські проблеми. Це одна з найпоширеніших відмов залізобетонних мостів.
Див. також
- Список руйнувань мостів
- Нержавіюча сталь
- Перетворювач іржі
- Сталь кортенівська
Примітки
- Тлумачення / значення слова "ИРЖА" | Словник української мови. Словник Грінченка. hrinchenko.com (ua). Процитовано 12 листопада 2018.
- ІРЖА – Академічний тлумачний словник української мови. sum.in.ua (укр.). Процитовано 12 листопада 2018.
- Interview, David Des Marais.
- Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 0-12-352651-5.
- Hubert Gräfen, Elmar-Manfred Horn, Hartmut Schlecker, Helmut Schindler "Corrosion" Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH: Weinheim, 2002. DOI: 10.1002/14356007.b01_08
Посилання
- Ржа // Українська мала енциклопедія : 16 кн. : у 8 т. / проф. Є. Онацький. — Накладом Адміністратури УАПЦ в Аргентині. — Буенос-Айрес, 1963. — Т. 6, кн. XII : Літери По — Риз. — С. 1585. — 1000 екз.
