Силікагель
Силікаге́ль — висушений гель кремнієвої кислоти пористої будови з сильно розвиненою внутрішньою поверхнею. Це зерниста, склоподібна, пориста форма діоксиду кремнію, добута синтетичним шляхом із силікату натрію.
| Силікагель | |
|---|---|
 Гранули сухого силікагелю | |
 Силікагель | |
| Інші назви | кремнію діоксид аморфний, кремнезем, ангідрид кремнієвої кислоти, аеросил, діатомова земля ,карбосил, кислота кремнієва синтетична з органічною обробкою, кремній діоксид колоїдний, неосил, порасил, силікагель аморфний, силоксид, тридиміт. |
| Ідентифікатори | |
| Номер CAS | 7631-86-9; 63231-67-4 (Silica gel) 112926-00-8; 7631-86-9; 63231-67-4 (Silica gel) |
| Номер EINECS | 272-489-0 |
| KEGG | D06521 |
| Назва MeSH | D01.837.725.700.379, D20.280.320.687 і D26.255.165.320.687 |
| RTECS | VV7310000 |
| SMILES | |
| InChI | |
| Властивості | |
| Молекулярна формула | SiO2 |
| Молярна маса | 60,08 г/моль |
| Молекулярна маса | 60 а. о. м. |
| Зовнішній вигляд | напівпрозорі зерна білого або жовтуватого (через домішки) кольору |
| Запах | без запаху |
| Густина | 640—700 кг/м³ |
| Тпл | + 1610 °С |
| Ткип | + 2950 °С |
| Розчинність (вода) | 149мг/100мл |
| Показник заломлення (nD) | 1,46 |
| Термохімія | |
| Теплоємність, c |
1 кДж/(кг*К) |
| Фармакологія | |
| DrugBank | D06521 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Загальний опис
Широко застосовується в господарстві як осушувач, носій каталізаторів, розділювач сумішей в хроматографічному аналізі, сорбент платинових металів, розділювач ізотопів радіоактивних металів.
У повсякденному житті найчастіше зустрічається у формі невеликих гранул, запакованих у маленькі паперові пакети (зазвичай 2×3 сантиметри), які можна знайти у придбаному взутті, в коробках з побутовими електронними приладами та ін. У цій формі силікагель використовується для контролю вологості для запобігання псуванню деяких товарів.
За масштабами застосування силікагель істотно перевершує активний оксид алюмінію і цеоліти. Хімічна інертність, висока термостійкість, легкість регулювання пористої структури — цей комплекс властивостей дає можливість приготування на основі силікагелю сорбентів, каталізаторів і носіїв з високою питомою поверхнею при оптимальній пористості структури.
Силікагель — це майже чистий діоксид кремнію SiO2, однак його технічні сорти містять домішки. Силікагель завжди містить більші чи менші кількості адсорбованої води (на цьому базується його широке використання як осушувача). Крім того, технічний силікагель містить інші оксиди, насамперед оксид алюмінію та заліза. Останній надає технічному силікагелю жовтуватого або навіть коричневого кольору.
Будова та механізм утворення
Дослідження будови силікагелю було досить тривалим процесом. Спочатку вчені провели детальне електронномікроскопічне вивчення золю кремнієвої кислоти і тих змін, які в ньому відбуваються в процесі старіння[1][2][3]. На електронномікроскопічному знімку свіжого приготованого золю, в якому переважає істинно-розчинена кремнієва кислота, не можна розрізнити якихось частинок чи агрегатів SiO2. Відносно великі частинки, зазвичай кулястої форми, розміром від декількох сотих до 0,1 мк, характерні для типових колоїдів, з'являються лише у процесі старіння золю.
Було проведене визначення діаметрів частинок стабілізованих силіказолей як в самих золях, методом розсіювання світла, так і після висихання на плівці електронномікроскопічним шляхом і вимірюванням питомої поверхні за величиною адсорбції парів азоту, отриманих із золів сухих порошків. Всі три способи вимірювань дали близькі величини діаметрів частинок[4]. Це дозволило зробити висновок про те, що частинки досліджених золів непористі, кулясті і настільки ущільнені, що при висиханні золю вже не стискаються. Розміри частинок залежать від способу приготування золю і коливаються від 20-30 до 150 Å, а в спеціально приготовлених стабілізованих золях досягають 600 Å.
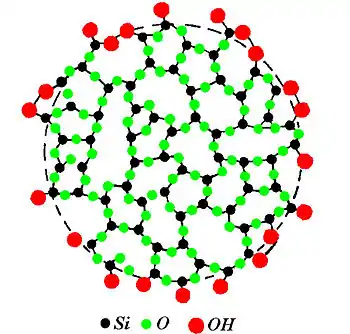
Поверхня цих частинок покрита гідроксильними групами, збереженими при конденсації ортокремнієвої кислоти[5]. Наявність на поверхні силікагелю гідроксилів, зв'язаних з атомами кремнію, було пізніше обґрунтоване Карманом, який дійшов до будови колоїдної кремнієвої кислоти виходячи з реальних структур кремнезему, що складаються з сітки тетраедрів SiO4 і відповідних за складом SiO2[6]. Збереження структурних одиниць SiO2 в цьому випадку припускає наявність на приграничній поверхні колоїдної кремнієвої кислоти незавершених тетраедрів. Прагнення поверхневих атомів кремнію до завершення тетраедричної координації з киснем обумовлює при контакті з вологою гідратацію поверхні кремнезему з утворенням ОН-групи. Розташування кремнекисневих тетраедрів всередині частинок золю і гелю кремнекислоти відрізняється від їх розташування в кристалі і близька до такої в склі[7][8][9]. Аморфна будова частинок золю в подальшому майбутньому була підтверджена електроннографічними даними.[10]
Таким чином, можна стверджувати, що частинки силікагідрозолю кулясті, складаються з неправильно розташованих кремнекисневих тетраедрів, поверхневий шар яких закінчується гідроксилами.
Силіказоль не є істинно рівноважною системою. Прагнення останньої до зменшення вільної енергії проявляється в самовільному переході золю в гідрогель. Гідрогель з плином часу також зазнає змін в результаті тих же конденсаційних процесів, які призводять до подальшого укрупнення і зростання первинних частинок.
Питанню гелеутворення кремнієвої кислоти присвячено багато робіт, проте механізм цього процесу повністю ще не з'ясований. Найбільшого поширення і визнання отримала міцелярна або фібрилярна теорія, за якою кремнегель утворюється в результаті послідовної хімічної конденсації низькомолекулярних кремнієвих кислот, що супроводжується виділенням води[11][12][13][14][15][16]. Ланцюги конденсованих полікремнієвих кислот, в свою чергу, сполучаються між собою перехресними зв'язками, утворюючи еластичну структуру, здатну, завдяки капілярним силам, утримувати велику кількість води або розбавленого розчину силікату. За цією гіпотезою структурною основою всієї гелеподібної системи є частинки високополімера, взаємно зв'язані між собою.
Конденсаційний механізм гелеутворення краще за інших пояснює такі властивості колоїдної кремнекислоти, як нечутливість золю до малих добавок солей, вплив концентрації водневих іонів на швидкість желатинізації, зростання pH в процесі желатинізації, незворотність гелю, еластичність та ін.[12][17][18][19]
Одержання
Процес приготування склоподібного силікагелю складається з отримання золю кремнієвої кислоти, його охолодження, дозрівання, синерезису, промивання і сушіння гелю.


Золь кремнієвої кислоти отримують різними способами: взаємодією лужного силікату з кислотами або кислими солями[20][21][22][23][24], гідролізом чотирихлористого кремнію[25][26][27][28][29][30], омиленням метилового або етилового ефірів кремнієвої кислоти[31][32], окисленням силану SiH4 озоном у водному розчині[29][30], електролізом лужних силікатів[33][34][35] та пропусканням водного розчину силікату натрію через колонку, заповнену катіонітом у водневій формі[36][37][38][39]. Всі ці методи, за винятком першого, застосовуються, головним чином, у лабораторних умовах. Світова промисловість в основному виготовляє силікагель з розчинного скла дією на нього сірчаної кислоти. Отримання кремнієвої кислоти за цим методом схематично зображається реакцією
Na2SiO3 + H2SO4 -> Na2SO4 + H2SiO3
Першою стадією процесу, незалежно від способу приготування, є утворення істинно розчиненої SiO2[27][40][11][41][42][1][43][12]. Потім прості кремнієві кислоти конденсуються до полікремнієвих кислот, молекулярна маса яких поступово збільшується. Розвиток процесу полімеризації призводить до утворення колоїдного розчину[27][11][42][1][43][12][6][2][3]. Укрупнення молекул кремнієвої кислоти багатьма дослідниками трактується як процес полімеризації, загальне рівняння якого представлене таким чином:
nSi(ОН)4 -> (SiO2)n + 2nH2O
З приводу механізму протікання зазначеного процесу існує багато думок[44]. Одна з теорій полягає в тому, що спочатку утворюються молекули Si(ОН)4, які укрупнюються завдяки процесу конденсації аж до застигання.
Способи регулювання пористої структури
Роль електролітів
Одним з істотних факторів, що впливають на пористу структуру силікагелю, є відзначений багатьма дослідниками вплив на гідрогель електролітів[23][24][45][46][47][48][49][50][51]. Результати, отримані при промиванні і просоченні гідрогелю електролітами, пояснюються різними причинами (пептизація, дегідратація та ін.) Однак при цьому слід враховувати і специфічні особливості їх дії.
Характер промивної рідини

Промивання гелю, осадженого в кислому середовищі, підкисленою водою (pH 3,5-5,5) призводить до утворення однорідно тонкопористих силікагелів з великою питомою поверхнею[52]. При промиванні гелю водопровідною водою отримуються порівняно великопористі силікагелі з великою адсорбційною ємкістю і значно меншою питомою поверхнею.
Формування дрібнопористої структури силікагелю з гідрогелю, промитого підкисленою водою, пояснюється більшою еластичністю його скелету, який легко деформується в процесі сушіння. Ефект водопровідної води відбувається за рахунок збільшення жорсткості каркаса гелю внаслідок утворення на поверхні його міцел гідрофобних ділянок, що сприяють прискоренню злипання первинних частинок.
При осадженні гелю кремнієвої кислоти в умовах надлишку силікату натрію отримуються так звані «лужні» силікагелі. Було встановлено, що гелі, осаджені в лужному середовищі, володіють великопористою структурою[24]. Промивання лужних гелів підкисленою водою призводить до збільшення кількості дрібних пор[48].
У цілому точно встановлено, що пориста структура силікагелю залежить від pH промивної рідини і рН осадження гідрогелю. Варіюючи ці умови, можна отримувати однорідно тонкопористі силікагелі, адсорбенти змішаної структури, в яких поряд з розвиненою мікропористістю існують пори перехідних розмірів і, зрештою, великопористі зразки.
Кислотна обробка гідрогелю
Обробка гідрогелю кремнієвої кислоти електролітами перед його зневодненням є одним з можливих шляхів зміни пористої структури силікагелів. Поряд з іншими електролітами перспективними в цьому сенсі є мінеральні кислоти. Відомо, що просочуванням гелю розчинами соляної[50] і сірчаної[53][54] кислот збільшує об'єм пор.
Просочування гідрогелю концентрованими соляною і азотною кислотами призводить до збільшення питомої поверхні ксерогелю і відповідно до зменшення розміру часток. При цьому соляна кислота майже не впливає на загальний об'єм пор, азотна його збільшує. Обробка гелю концентрованою сірчаною кислотою, залишаючи незмінною величину питомої поверхні, викликає різке збільшення радіусу пор і їх загальний об'єм. Найбільший ефект збільшення пористості при обробці концентрованими мінеральними кислотами дає сірчана кислота, потім азотна і, зрештою, соляна.
Таким чином, змінюючи концентрацію кислоти і її природу, а також умови осадження гідрогелю, що піддається кислотній обробці, можна отримувати силікагелі з різноманітною пористою структурою.
Вплив умов старіння гідрогелю кремнієвої кислоти

При зберіганні гелів в них відбуваються зміни, пов'язані з агрегацією частинок, збільшенням їх розмірів, зміною ступеня гідратації і безперервним ущільненням просторового каркаса. Характер цих змін залежить від природи взятих колоїдів і взаємодії елементів їх структури з дисперсійним середовищем. Глибокий вплив на старіння здійснюють умови зовнішнього середовища, змінюючи які можна затримувати або прискорювати цей процес.
У випадку гелю кремнієвої кислоти фізичне старіння супроводжується хімічним, що обумовлено наявністю на поверхні частинок гелю реакційноздатних гідроксильних груп. На швидкість синерезису і подальшого старіння гелю впливають: pH середовища, температура, присутність в інтерміцелярній воді розчинних у ній органічних речовин та ін.
pH середовища старіння
Кисле середовище гальмує процес старіння, причому стабілізуюча дія кислоти проявляється меншою мірою зі збільшенням віку гелю. Ймовірно головним змістом синерезису гелю кремнієвої кислоти є повільно протікаюча реакція конденсації гідрофільних силанольних груп. Переривання її впливом на гель кислого середовища веде до утворення більш дрібних частинок (збільшення питомої поверхні) і більш щільного їх упакування (зменшення об'єму та радіусу пор).
Старіння в мінеральних кислотах
Старіння силікагелю в мінеральних кислотах прискорюється іонами Н+ і ОН-, причому нижче pH 2 швидкість процесу пропорційна концентрації гідроксильних іонів. При pH <2 старіння прискорюється також невеликими кількостями іону фтору.
Старіння в органічних середовищах
Застосовані як середовище старіння ацетон, діоксан, гліцерин та етиловий спирт протягом тривалого часу оберігають структуру вихідного гідрогелю від старіння. Тобто, органічні сполуки при старінні виконують ту ж функцію, що й кислота з pH 2 — перешкоджають росту частинок. Стабілізуюча дія цих речовин пояснюється утворенням навколо частинок гелю адсорбційно-сольватних оболонок у зв'язку з виникненням комплексів між електроннодонорними атомами кисню молекул органічних речовин і воднем поверхневих гідрофільних силанольних груп.
Органічна рідина в процесі формування пористої структури силікагелів володіє подвійною функцією: з одного боку, вона стабілізує дану дисперсність часток гелю, з іншого — визначає ступінь його стиснення під дією капілярних сил при сушінні.
Гідротермальне старіння гідрогелю
Термодинамічно вже давно обґрунтоване явище розчинення дрібних і ріст великих частинок, що знаходяться в розчині, насиченому у відношенні до дрібних частинок. Процес повторюється до переходу системи в стійку термодинамічну рівновагу. Однак у звичайних умовах такий процес протікає дуже повільно. Його інтенсивність зростає із збільшенням температури, що підвищує розчинність дисперсної фази. Чим більша розчинність дисперсної фази, тим процес йде швидше. Це явище було покладено в основу регулювання пористої структури силікагелю методом гідротермального старіння (витримування гідрогелю у воді при різних температурах в автоклаві).
Коротко процес відбувається так: у міру збільшення тривалості і температури гідротермального старіння гідрогелю питома поверхня ксерогелю зменшується, а граничний сорбційний об'єм пор збільшується. При цьому основні зміни в структурі відбуваються в перші 20—40 год, після чого структура ксерогелю змінюється дуже незначно. Подальші її зміни досягаються лише з підвищенням температури старіння.
Таке протікання процесу пояснюється збільшенням первинних глобул вихідного гідрогелю та зменшенням щільності їх упакування в процесі гідротермальної обробки[55]. Укрупнення глобул при гідротермальному старінні є наслідком підвищення розчинності SiO2 з ростом температури[56][57][58]. Протікає даний процес так: вода розщеплює силоксанові зв'язки на поверхні частинок гідрогелю і діаметр глобул зростає за рахунок розчинення найменших з них і перенесення кремнієвої кислоти на поверхню більш великих. Так само розчиняються і великі глобули гідрогелю, головним чином в місцях з найбільшою кривизною поверхні, внаслідок чого відбувається згладжування її геометричної неоднорідності[59].
Таким чином, при гідротермальному старінні гідрогелю його глобули, збільшуючись у розмірах, стають більш однорідними за всією величиною, більш сферичними і менш «шорсткими», більш однорідною стає і їх упакування.
Це відбивається на структурі отримуваних ксерогелів: їх питома поверхня зменшується, об'єм і діаметр пор збільшуються, вони стають все більш однорідно пористими.
Роль інтерміцелярної рідини у формуванні пористої структури

Вплив природи інтерміцелярної рідини на стиснення скелету гелю кремнієвої кислоти при його зневодненні була відома вже давно. В основу досліджень у цій області була покладена відкрита можливість заміщення води гідрогелю спиртом, оцтовою кислотою, гліцерином, концентрованою сірчаною кислотою і рядом інших речовин[60].
Заміна води на органічну рідину призводить до значного збільшення загального об'єму і радіусу пор ксерогелю. При цьому також дещо зростає і питома поверхня зразків.
Вплив деяких умов отримання гідрогелю на пористу структуру
Регулювання пористої структури силікагелю здійснюють за допомогою зміни pH гелеутворення, наступної обробки гідрогелю перед сушінням і зміни умов старіння. Крім цього пориста структура силікагелю залежить також від способу отримання золю і перетворення його в коагель.
Силікагелі із силікату натрію і солей, що легко гідролізують
При взаємодії розчинів силікату натрію і солей, що легко гідролізують, відбувається миттєве випадання пластівчастого осаду — коагелю кремнієвої кислоти і нерозчинного гідрату оксиду металу. Осад відфільтровують, підсушують до певного вмісту вологи, видаляють з нього гідрат оксиду металу кип'ятінням в кислоті, відмивають від солей і сушать. Отримані таким шляхом ксерогелі кремнієвої кислоти непрозорі. У процесі осадження такого силікагелю, у зв'язку з безперервною зміною pH суміші, утворений гель є неоднорідним як за складом, так і за дисперсністю, що, безсумнівно, повинно позначитися на кінцевій пористій структурі ксерогелю.
Такі силікагелі характеризуються досить широким розподілом пор за їх радіусами. Поряд з тонкими порами вони містять перехідні і макропори найрізноманітніших розмірів.
Силікагелі з концентрованих золів кремнієвої кислоти
Одним з можливих шляхів регулювання пористої структури силікагелів є шлях, оснований на використанні як вихідної сировини концентрованих золів кремнієвої кислоти, розмір колоїдних частинок яких піддається регулюванню в процесі отримання золю. Для цього спочатку отримують розбавлений золь зі значенням pH 3,0 пропусканням розчину рідкого скла через катіоніт в водневій формі і доводять pH золю до 7,3 введенням в нього лугу[61]. Один об'єм лужного золю кип'ятять визначений час, після чого додають до нього другий об'єм холодного лужного золю і продовжують кип'ятіння всієї маси золю в посудині. При цьому вважають, що на першій стадії при кип'ятінні золю відбувається поліконденсація первинних відносно дрібних частинок і збільшення їх розмірів, а на другій стадії — подальше зростання часток відбувається вже в основному за рахунок конденсації доданих полікремнієвих кислот з холодного золю на утворених на першій стадії ядрах конденсації. Гелі, приготовані випаровуванням водних золів, сушать при температурі 80-100 і потім 180–200 °С.
Основними чинниками, що визначають пористу структуру силікагелів, отриманих з концентрованих золів кремнієвої кислоти, є дисперсність кремнезолей і концентрація їх желатиноутворення. З підвищенням останньої розмір глобул і координаційне число зростають, а сумарна пористість зразків зменшується. Таким чином, зростання глобул супроводжується все більшим їх ущільненням. Характерно, що радіус пор в цих випадках залишається без змін.
Силікагелі із спирто-водних золів
Отриманий гідролізом етилового ефіру ортокремнієвої кислоти з використанням соляної кислоти як каталізатора гідролізу спирто-водний золь кремнієвої кислоти містить 20 % SiO2. Желатинізація золю в даному випадку відбувається через три-чотири доби. Далі наступає синерезис з виділенням інтерміцелярної рідини.
Силікагель, приготований зі спирто-водного золю, за сорбційними властивостями різко відрізняється від силікагелів з водних золів кремнієвої кислоти. Його істинна густина за бензолом (2,07 г/см³) менша від істинної густини аморфного SiO2 (2,2 г/см³), що свідчить про недоступність частини об'єму його пор для молекул бензолу. Внаслідок цього адсорбційна ємність зразка за бензолом менша, ніж за водою. У ньому практично відсутні перехідні пори, динамічна активність за парами води наближається до динамічної активності цеолітів і становить 86 мг/см³ при точці роси повітря, яке осушують, нижче −70 °С. Ці характеристики свідчать про те, що з концентрованого спирто-водного золю кремнієвої кислоти утворюється мікропористий силікагель з порами молекулярних розмірів.
Силікагелі, отримані вуглекислотним методом
Дослідження процесу карбонізації розчинів силікату натрію показало, що в залежності від умов карбонізації і подальшої обробки осадженої кремнієвої кислоти остання може мати різну структуру і різні фізико-хімічні властивості[62]. Карбонізація в діапазоні низьких температур і за відсутності електроліту приводить до утворення структурованого осаду — гелю, після відповідної обробки якого може бути отриманий активний і міцний силікагель.
При цьому методі карбонізацію закінчують при pH 9,5-9,8. осаджену кремнієву кислоту після синерезису відфільтровують, обробляють H2SO4 до pH 4, промивають дистильованою водою до видалення слідів іону SO42- і сушать при температурі 180 °С. Пористість отриманих таким чином силікагелів залежить від температури карбонізації і вмісту SiO2 в розчині.
Геометричне модифікування силікагелю
Впровадження нових адсорбційних процесів вимагає розробки високоактивних і високоміцних адсорбентів. У ряді випадків адсорбент повинен відповідати певним вимогам за структурними характеристиками, мати однорідну в хімічному та адсорбційному відношенні поверхню і володіти високою механічною міцністю. Ці вимоги не завжди можна задовольнити, отримуючи силікагелі способом осадження.
Одним з перспективних напрямків отримання сорбентів з бажаними параметрами структури є геометричне модифікування силікагелю. Його можна здійснити шляхом видалення речовини з поверхні, використовуючи, наприклад, процеси травлення у рідкому або газоподібному середовищі, часткового розчинення тощо Другий шлях заснований на диспергуванні силікагелю з подальшим формуванням тонкодисперсного порошку за допомогою сполучення в механічно міцні гранули (конструювання бідисперсних адсорбентів).
Гідротермальна обробка силікагелів
Встановлено, що обробкою промислового силікагелю водяною парою в автоклаві при тиску 50—280 атм (від 140 до 350 °С) можна змінювати питому поверхню адсорбентів від 280 (вихідний зразок) до 5 м²/г, а розмір пор від 100 до 7000 А[63][64]. Чим вища температура і, відповідно, тиск пари, тим менша питома поверхня і більший діаметр пор. При цьому сумарний об'єм пор залишається постійним, а гранично-сорбційний, визначений за адсорбцією насиченої пари бензолу, значно знижується і у зразків з питомою поверхнею 20 м²/г складає всього 0,01-0,07 см³/г.
Електронномікроскопічне дослідження показало, що зниження питомої поверхні промислового силікагелю ШСК від 300 до 40 м²/г при гідротермальній обробці зумовлене головним чином зростанням глобул[65].
Вплив агресивних середовищ
На розчинності кремнезему основані також методи регулювання пористої структури силікагелю обробкою його лугом і плавиковою кислотою[66]. Вплив лугу на пористі скла призводить до повного або часткового руйнування їх тонкої структури[67]. Такі ж результати отримуються при обробці лугом тонко- і крупнопористого силікагелів[66]. У першому випадку радіус пор зростає від 7 до 37 А, а в другому від 37 до 47 А. Аналогічним чином змінюється структура силікагелю під впливом плавикової кислоти. Характерно, що збільшення радіусу пор при обробці силікагелю плавиковою кислотою компенсується зменшенням гранично-сорбційного об'єму пор і появою невеликого об'єму макропор.
Одним з методів геометричного модифікування силікагелю може служити прожарювання його з невеликими добавками соди. У порівнянні з гідротермальною обробкою в автоклаві даний спосіб модифікування значно простіший, проте отримані таким чином макропористі силікагелі володіють менш однорідною структурою.
Конструювання пористої структури з порошків силікагелів
Метод формування пористих структур з ксерогелів за допомогою зв'язувальних набуває великого інтересу у зв'язку з можливістю конструювання досить ефективних в каталізі бідисперсних структур каталізаторів і носіїв і, з іншого боку, як спосіб додання силікагелю водостійкості. Застосування цього методу ще пов'язують з пошуком шляхів управління механічними властивостями контактів і адсорбентів — міцністю і зносостійкістю зерен. Метод полягає в склеюванні частинок заданого розміру, що володіють внутрішньою пористістю, за допомогою зв'язувальних. При цьому розмелений силікагель певного гранулометричного складу змішують зі зв'язувальним вручну, потім на вальцях і, нарешті, в змішувачі до отримання однорідної еластичної маси. Пасту формують і сушать.
Структура силікагелів, отриманих методом склеювання, розглядається як біглобулярна, тобто така, що складається з частинок двох розмірів[68].
Адсорбенти, отримані за методом склеювання, зазвичай характеризуються великою міцністю, яка тим вища, чим вищий ступінь подрібнення вихідного адсорбенту до склеювання. Міцність таких адсорбентів залежить від числа контактів між частками[69][70].
Промислові марки силікагелю
| Величина зерен, мм | ||||||||
| Граничний вміст зерен дрібніших ніж нижня межа | ||||||||
| Граничний вміст зерен більших ніж верхня межа, % | ||||||||
| Насипна маса в перерахунку на суху речовину, не менше г/л | ||||||||
| Статична активність за водяною парою при 20 °C і відносній вологості, не менше %: 20 40 60 100 | ||||||||
| Вміст: діоксиду кремнію в перерахунку на суху речовину, не менше % соляної кислоти | ||||||||
| Втрати при прокалюванні при 600–700 °C, не більше % | ||||||||
Хімічно модифіковані силікагелі
Адсорбційні властивості силікагелів поряд з геометрією структури і пористістю в значній мірі залежать від хімічної природи їх поверхні.
Поверхня силікагелів покрита гідроксильними групами. Адсорбційні та інші властивості силікагелів залежать від кількості та концентрації на їх поверхні цих гідроксильних груп. Зміна хімічної природи поверхні силікагелів в результаті термічної дегідратації, регідратації або внаслідок заміщення гідроксилів на різні атоми або органічні радикали викликає різку зміну адсорбційних і технологічних властивостей силікагелю.
У зв'язку з тим, що електронна d-оболонка кремнію не заповнена, розподіл електронної густини в гідроксильних групах поверхні силікагелю виглядає так: негативний заряд сильно зміщений до атома кисню, а атом водню частково протонований і утворює протонний кислотний центр. Це забезпечує специфічну взаємодію поверхні силікагелю зі зв'язками або ланками молекул, які володіють зосередженою на периферії електронною густиною. Тому природно, що при частковому або повному заміщенні гідроксильних груп силікагелю атомами фтору або органічними радикалами, завдяки виключенню з адсорбційного процесу всіх або частини гідроксилів, спостерігається зменшення адсорбції речовин, у яких в адсорбційній взаємодії провідну роль відіграє донорно-акцепторна компонента.
Модифікування поверхні силікагелів органічними радикалами з чітко вираженими основними або кислотними властивостями призводить до отримання специфічних адсорбентів, що вибірково поглинають речовини кислотного або основного характеру, для яких такі радикали є активними центрами адсорбції. Характер адсорбційних властивостей модифікованих силікагелів з функціональними групами визначається як розмірами радикалів, так і його хімічними властивостями.
Застосування

З кожним роком силікагель застосовується все ширше в найрізноманітніших галузях народного господарства. Завдяки гідрофільним властивостям поверхні силікагелю його часто використовують для осушування повітря[71][72][73][74], вуглекислого газу, водню, кисню, азоту, хлору і інших промислових газів[74][75]. Здатність силікагелю поглинати значні кількості води є визначальною також і для осушення різних рідин, особливо в тому випадку, коли рідина, що зневоднюється, погано розчиняє воду. Наприклад, сушка галогенованих рідин типу фреону[74]. Силікагелі служать також осушувачами при консервації устаткування для захисту його від корозії.
Поряд з водою силікагель добре сорбує пари багатьох органічних речовин. Цією його властивістю користуються для вловлювання (рекуперації) парів цінних органічних розчинників — бензину, бензолу, ефіру, ацетону тощо з повітря, бензолу з газових коксових печей і бензину з природних газів[71][72][73][74][76].
Властивість силікагелю поглинати велику кількість речовин з рідкої фази використовують в промисловому очищенні різних олив, при знесірченні нафтових погонів і видаленні з нафти високополімерних смолистих речовин[73][74][76].
За допомогою гелю кремнієвої кислоти проводиться хроматографічне розділення і аналіз сумішей, що основане на вибірковості адсорбційної дії силікагелю у відношенні до речовин різної хімічної природи.

Так, на силікагелі кількісно виділяють ароматичні, а також ненасичені вуглеводні з їх сумішей з парафінами і нафтенами[74][77]. Цим методом широко користуються в дослідженнях хімічного складу бензинів[77]. Хроматографія за допомогою силікагелю дала можливість вирішити проблему очищення індивідуальних вуглеводнів різної будови, потреба в яких стає вельми нагальною для хімічних і фізичних досліджень, а особливо для спектроскопії. До найбільш важких видів очищення належать: видалення слідів води та домішок вуглеводнів, звільнення ароматичних вуглеводнів від домішок парафінів і нафтенів, а також поділ сумішей деяких ізомерних вуглеводнів. Зразки нафтенових і парафінових вуглеводнів, очищені за допомогою хроматографії на силікагелі, можуть бути призначеними для визначення фізичних констант і спектральних досліджень[77].
У фармацевтичній промисловості хроматографія на силікагелі застосовується для концентрування і виділення антибіотиків з культуральної рідини[74].
Силікагель каталізує багато хімічних реакцій. Ксерогелі кремнієвої кислоти виявляють значну каталітичну активність в тих випадках, коли реакція супроводжується утворенням або споживанням води, наприклад у реакціях етерифікації, перетворення ароматичних галогенпохідних у відповідні феноли[74][78][79][80][81] і т. д. В той же час він є поширеним каталізатором багатьох інших хімічних процесів, таких як полімеризація, конденсація, окислення, відновлення органічних речовин та ін[82].
Силікагель є одним з поширених носіїв каталізаторів і служить компонентом багатьох складних контактів. Він використовується як носій найрізноманітніших каталітично активних речовин — металів Pt, Pd, Ni тощо, оксидів, кислот, основ — для процесів окислення, гідратації, гідрування, полімеризації, конденсації і багатьох інших реакцій[81].
Останнім часом силікагелі широко використовуються як іоніти для розділення радіоактивних ізотопів, очищення промислових стічних вод від іонів різних металів і засобів медичної допомоги при інтоксикації радіоактивними речовинами[83].
Переваги
Найважливішою перевагою силікагелю в порівнянні з природними пористими матеріалами (пемза, азбест) є можливість зміни його структури в процесі формування. Цей фактор є особливо важливим тому, що ступінь і характер пористості силікагелю обумовлюють ефективність його застосування в різних процесах. При даній пористій структурі адсорбційна активність визначається концентрацією адсорбованої речовини і розміром її молекул.
Проте геометрична структура силікагелю не є єдиним чинником, що визначає його адсорбційну активність. Важливу роль також відіграє хімічна природа його поверхні. Останню можна змінювати термічною дегідратацією, проведенням на поверхні силікагелю різних реакцій, за допомогою яких утворюються нові сполуки. До таких реакцій належать алкоксилювання, хлорування, взаємодія поверхні силікагелю з алкіл- та арилхлорсиланами і т. д.[84]
Однією з важливих переваг силікагелю є його інертність. Він вважається хімічно і біологічно нешкідливим.
Додає поширеності цьому адсорбенту і той факт, що його можна синтезувати в достатньо широкому інтервалі заданих структурних характеристик при використанні досить простих технологічних процесів. Крім того, для його регенерації необхідна відносно низька температура (100–200 °C), що значно зменшує промислові енерговитрати.
Силікагель є пожежо- і вибухобезпечним матеріалом, що сприяє його розповсюдженню в промислових процесах технологічних установок.
Див. також
Примітки
- Берестнева 3. Я., Дорецкая Т. А., Каргин В. А.- Коллоидн. журн., 1949, 11, 369.
- Берестнева 3. Я, Корецкая Г. А., Каргин В. А.— Коллоидн. журн., 1950, 12, 338.
- Берестнева 3. Я., Каргин В. А.— Усп. химии, 1955, 24, 249.
- Alexander G. В., Jler R. К — J. Phys. Chem., 1953, 57, 932.
- Киселев А. В. — Коллоидн. журн., 1936, 2, 17.
- Carman Р. С.— Trans. Farad. Soc., 1940, 36, 954.
- Weyl W. A. — Research, 1950, 3, 230.
- Hauser Е. А. а. Beau D. S. — J. Phys. Chem., 1952, 56, 136.
- Алесковский В. Б. — В кн.: Вопросы химической кинетики катализа и реакционной способности. Изд-во АН СССР, М., 1955, 569.
- Лукьянович В. М., Леонтьев Е. А. — Докл. АН СССР, 1955, 103, 1039.
- Willstetter R., Kraut H. u. Lobinger K.— Ber., 1925, 58, 2462.
- Hurd Ch. В.— Chem. Rew., 1938, 22, 403.
- Spenser R. W., Middleton А. В. a. Merrill R. С.— Ind. Eng. Chem., 1951, 43, 1129.
- Jler R. K. — J. Phys. Chem., 1953, 57, 604.
- HurdCh. B.u. Friderick J. a. Haynes C. R. — J. Phys. Chem., 1938, 42, 85.
- Kistler S. S., Fischer E. A., Freeman J. R. — J. Amer Chem. Soc., 1943, 65, 1909.
- Hurd Ch. В. a. Marotta A. — J. Amer. Chem. Soc., 1940, 62, 2767.
- Plank C. J. — J. Coll. Sci., 1947, 2, 413.
- Hurd Ch. B., Pomatti R. C., Spittle J. H. a Alois F. J. — J. Amer. Chem. Soc., 1944, 66, 388.
- Van Bemmelen J. M.— Z. anorg. allg. Chem., 1897, 13, 233.
- Patrick W. A., McGawack J.— J. Amer. Chem. Soc., 1920, 32, 946; W. A. Patrick a. Optycke, ibid., 1925, 29, 601; W. A. Patrick a. W. P. Eberman, ibid., 1925, 29, 220.
- Fells H. A. a. Firths J. B.— J. Phys. Chem., 1925, 29, 241.
- Окатов А. Б.— ЖПХ, 1929, 2, 21; Коллоидная кремнекислота и ее адсорбционные свойства, Л., Изд-во Военно-технической Академии РККА, 1928.
- Хармадарьян М. О., Копелевнч Е. Л.— Журн. хим. пром., 1930, 7, 1484.
- Брунс Б. Н., Костина Е. А.— ЖПХ, 1935, 8, 1004.
- Ebler Е. u. Tellner L.— Вег., 1911, 44, 1915.
- Brintzinger U. u. Тготег В,— Z. anorg. allg. Chem., 1929, 181, 237.
- Брунс Б. П., Шатуновская Е. Г.— Журн. хнм. пром.,1932, 34.
- Kargin V. A. a. Rabinovitch A. J.— Trans. Faraday Soc., 1935, 31, 284.
- Байбаев А. И., Каргин В. А.— ЖФХ, 1936, 6, 13.
- Grimaux Е. С. r., 1884, 98, 1434.
- Brintzinger H. W.— Z. anorg. Chem., 1931, 195, 49.
- Kroger М.— К Koll. Z., 1932, 30, 16.
- Treadwell W. D.— Trans. Faraday. Soc., 1935, 31, 297.
- Treadwell W. D. u. Kong W. — Helv. Chim. Acta, 1933, 16, 468.
- Ryznar J. W.— Ind. Eng. Chem., 1944, 38, 281.
- Hazel F.— J. Phys. a. Coll. Chem., 1947, 51, 45.
- Alexander J. B.— J. Amer. Chem. Soc., 1953 , 75, 2887.
- Karas F. a. Pelikan J. Chemicky Pramysl, 1958 , 8, (33), 59.
- My1ius F. u. Groschuff E.— Ber., 39, 116 (1906).
- Schwarz W. u. Menner E.— Ber., 1924, 57, 1477.
- Kraut H.— Ber., 1931, 64, 1709.
- Егорова Е. Н. — Изв. АН СССР, ОХН, 1954, 16.
- Айлер Р. К. Коллоидная химия кремнезема и силикатов. Гос-стройиздат, М., 1959.
- Хармадарьян М. О., Копелевич Е. А. — Укр. хим. журн., 1933, 8, книга 1, 32.
- Хармадарьян М. О., Марков В. К. — Укр. хнм. журн., 8, 1933, книга 1, 1.
- Хармадарьян М. О., Копелевич Е. П. — ЖФХ, 1935, 6, вып. 10, 1425.
- Марков В. К., Нагорная Н. А. — ЖПХ, 1937, 10, 853.
- Plank С. J. a. L. С. Drake — J. Coll. Sci., 1947, 2, 399.
- Боресков Г. К. и др. — ЖФХ, 1948, 22, 603.
- Крестинская В. Н. — Коллоидн. журн., 1946, 8, 401.
- Неймарк И. Е., Шейнфайн Р. Ю. — Коллоидн. журн., 15, 45 (1953).
- Holmes H. N. a. Anderson J. A. — Ind. Eng. Chem., 1925, 17, 280.
- Holmes H. N., Sullivan R. W. a. Metcalf N. W. — Ind. Eng. Chem., 1926, 18, 386; H. N. Holmes a. A. L. Elder. — J. Phys. Chem., 1931, 35, 82.
- Чертов В. М., Джамбаева Д. Б., Неймарк И. Е. — Коллоидн. журн., 1965, 27, 279.
- Ashley V. D., Jnnes О. В. — Ind. Eng. Chem., 1952, 44, 2857.
- Акшинская Н. В. и др. — ЖФХ, 1964, 38, 488.
- Киселев А. В., Леонтьев E. А., Лукьянович В. М., Никитин Ю. С. — ЖФХ, 1956, 30, 2149.
- Акшинская Н. В. и др. — Коллоидн. журн., 1966, 28, 164.
- Th. Graham — Phil. Trans., 1961, 151, 183.
- Bechtold M. F., Snyder O. E. — Патент США 2574902, 1951.
- Далматская Е. И., Голодис С. Л. — ЖПХ, 1969, 42, 1958.
- Акшинская и др. — ЖФК, 1962, 36, 2277.
- Акшинская Н. В., Киселев А. В., Никитин Ю. С. — ЖФК, 1963, 37, 921
- Киселев В. А. и др. — Коллоидн. журн., 1968, 30, 842
- Неймарк И. Е., Слинякова И. Б. — Доклад АН УССР, 1955, 5, 469
- Жданов С. П. — Докл. АН СССР, 1952, 82, 281.
- Дзисько В. А. и др. — Кинетика и катализ, 1968, 9, 668.
- Ребиндер П. А., Марголис Л. Я., Щукин Е. Д. — Докл. АН СССР, 1964, 151, 695.
- Дзисько В. А., Тарасова Д. В., Вишнякова Г. П. — Кинетика и катализ, 1967, 7, 193.
- Дубинин М. М. Физико-химические основы сорбционной техники, 2-е изд. — ОНТИ, 1935.
- Алексеевский Е. В. Общий курс химии защиты, ч. 1. — ОНТИ Химтеорет., Л., 1935.
- Никитин С. Н. Силикагель и его применение в черной металлургии. — Москва: Металлургиздат, 1941.
- Hubard S. S. Encyclopedia of chemical technology. — New York, 1954, 12, 345–360.
- Mantell G. L. Adsorption, 2-nd. ed. — N. Y., L., 1951.
- Mantell G. L. Adsorption, 2-nd. ed. — N. Y., L., 1951.
- Михайлова Е. А., Казанский Б. А. Исследования в области хроматографии. — Изд-во АН СССР, 1952, 155.
- Ворожцов Н. Н. Основы синтеза промежуточных продуктов и красителей. — Москва: Госхимиздат, 1955. С. 364.
- Фрейдлин Л. X. Успехи химии. — 1954, 23, 581.
- Дзисько В. А. Рациональные основы приготовления некоторых окисных катализаторов. Доклад по опубликованным работам. — Новосибирск, 1965.
- Каталитические свойства веществ. Под редакцией В. А. Ройтера — Київ: Наукова думка, 1968.
- Беркман С., Морелл Д., Эглофф Г. Катализ в неорганической и органической химии, книга вторая. — Москва: Гостоптехиздат, 1949.
- Гриссбах Р. Теория и практика ионного обмена. — Москва: ИЛ. 1963
- Неймарк И. Е., Шейнфайн Р. Ю. Силикагель, его получение, свойства и применение. — Київ: Наукова думка, 1973. С. 7-8.
Література
- Неймарк И.Е., Шейнфайн Р.Ю. Силикагель, его строение и химические свойства. — Л. : Госхимиздат, 1963. — 200 с. — 1200 прим. (рос.)
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2013. — Т. 3 : С — Я. — 644 с. Стаття "Силікагель".
- Кольцов С.И., Алесковский В.Б. Силикагель, его получение, свойства и применение. — Київ : Наукова думка, 1973. (рос.)
- Никитин С.Н. Силикагель и его применение в черной металлургии. — М. : Металлургиздат, 1941. (рос.)
- Ralph K. Iler. The Chemistry of Silica. Solubility, Polymerization, Colloid and Surface Properties, and Biochemistry. — New York/Chicester/Brisbane/Toronto/Singapore : John Wiley & Sons, 1979. — 866 с. — ISBN 0-471-02404-X. (англ.)
- Raymond Peter William Scott. Silica gel and bonded phases: their production, properties, and use in LC. — Wiley, 1991. — 261 с. (англ.)
- Horacio E. Bergna. The Colloid chemistry of silica. — Washington : American Chemical Society, 1991. — 695 с. — ISBN 0841221030. (англ.)
Посилання
- Значення терміну силікагель в «Академічному тлумачному словнику (1970–1980)». Архів оригіналу за 21 червня 2013.
- ГОСТ 3956-76. Силикагель технический. Технические условия (рос.). Архів оригіналу за 21 червня 2013.
- ГОСТ 8984-75. Силикагель-индикатор. Технические условия (рос.). Архів оригіналу за 21 червня 2013.
- Паспорт безпеки матеріалу (англ.). Архів оригіналу за 1 грудня 2005.
- Силікагель з індикатором вологості: інструкція до застосування (англ.). Архів оригіналу за 21 червня 2013.
|
|
Ця стаття належить до добрих статей української Вікіпедії. |
