Корозія
Коро́зія мета́лів — самопливне руйнування металів і сплавів, а також інших речовин у результаті хімічної, електрохімічної або фізико-хімічної взаємодії з навколишнім середовищем. До основних видів корозії за її механізмом відносять хімічну, електрохімічну, а також біологічну.

Загальна характеристика
Корозія — це природний процес, який перетворює очищений метал на більш хімічно сталу форму, таку як: його оксид, гідроксид, карбонат або сульфід. Це поступове руйнування матеріалів (зазвичай металів) шляхом хімічної та / або електрохімічної реакції з довкіллям. Корозійна інженерія — це галузь, яка займається контролем та запобіганням корозії.
У найбільш поширеному вживанні цього слова, воно означає електрохімічне окислення металу внаслідок реакції з окисником, таким як кисень або сульфати. Іржавіння, утворення оксидів заліза, є відомим прикладом електрохімічної корозії. Цей вид пошкоджень, як правило, утворює оксид (и) або сіль (і) первинного металу і призводить до характерного помаранчево-бурого забарвлення. Корозія може також виникати в інших матеріалах, ніж метали, таких як кераміка або полімери, хоча у цьому сенсі, термін «деградація» є більш придатним визначенням. Корозія знижує корисні властивості матеріалів і конструкцій, такі як: міцність, зовнішній вигляд та проникність щодо рідин і газів.
Багато конструктивних сплавів піддаються корозії лише під впливом вологи в повітрі, але на процес може сильно вплинути дія певних речовин. Корозія може бути зосереджена локально, утворюючи заглибину чи тріщину, або вона може поширюватись на широку площу, більш-менш рівномірно корозуючи поверхню. Оскільки корозія — це процес, керований дифузією, вона виникає на відкритих поверхнях. Отже, способи зниження активності відкритої поверхні, такі як пасивація і хроматування, можуть підвищити корозійну стійкість матеріалу. Пасивація полягає у нанесенні на метал хімічним або електрохімічним шляхом оксидних, фосфатних й інших плівок. Проте, деякі механізми корозії менш помітні та менш передбачувані.
Хімія корозії складна; її можна вважати електрохімічним явищем. Під час корозії в певній точці на поверхні предмета, виготовленого із заліза, відбувається окислення, і ця пляма веде себе як анод. Електрони, що вивільняються в цій анодній плямі, рухаються крізь метал і переходять до іншої точки на металі і відновлюють кисень у цьому місці в присутності H+ (який, як вважають, доступний з H2CO3, що утворюється внаслідок розчинення вуглекислого газу з повітря у воді в вологому повітрі атмосфери. Іон водню у воді також може бути доступним завдяки розчиненню інших кислотних оксидів з атмосфери). Ця пляма веде себе як катод.
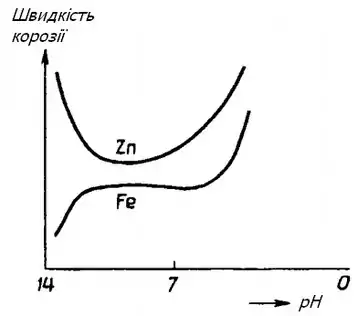
На перебіг корозії великий вплив має pH середовища внаслідок водневої або кисневої деполяризації[1].
Різновиди корозії
Загальна і локальна корозія
- Загальна (нерівномірна) корозія — це процес, що протікає на всій або на якій-небудь частині поверхні металу зі швидкістю 0,1 — 0,5 мм/рік. Результатом загальної корозії є суцільне руйнування поверхні металу або якої-небудь частини його поверхні, крім того глибина проникнення корозії на одних ділянках може бути дещо більше, ніж на інших. Значно частіше поверхня металу піддається локальній корозії, характерною особливістю якої, є висока швидкість руйнування металу на окремих ділянках, що досягає 1 — 10 мм/рік. Наслідком локальної корозії є руйнування металу в глибину аж до появи наскрізних отворів, при цьому сусідні ділянки можуть практично не зачіпатися корозією.
- Основними видами локальної (місцевої) НКТ є:
- пітингова (виразкова) корозія;
- корозія плямами;
— корозія у вигляді борозенок (канавок);
- корозія у вигляді плато;
- мейза-корозія;
- контактна корозія;
- підплівкова корозія;
- гальванічна корозія.
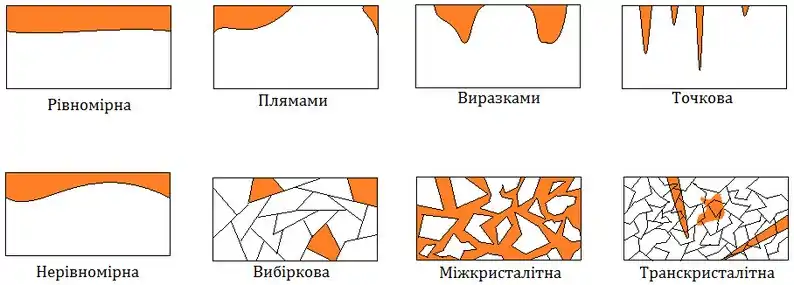
Місцева (локальна) корозія буває у вигляді плям, виразок, точок (пітингова); вона може бути вибіркової (наприклад, знецинкування латуні), міжкристалітною (інтеркристалітною), транскристалітною; до місцевої корозії відноситься також корозійне розтріскування. В умовах експлуатації виробів для силового елементу конструкції найбільш небезпечна міжкристалітна корозія корозійне розтріскування, для резервуару, трубопроводу або реактору — точкова або виразкова корозія, оскільки порушується герметичність при появі хоча б одного наскрізного отвору, для поверхонь тертя — загальна корозія[2][3][4].
Хімічна корозія
Хімічна корозія відбувається в середовищах, які не проводять електричного струму. Вона обумовлюється дією на
метали неелектролітів (спирту, бензину, мінеральних мастил тощо) і сухих газів (кисню, оксидів азоту, хлору, хлороводню, сірководню та інше) при високій температурі (так звана газова корозія).
У результаті взаємодії металів із зовнішнім середовищем їх поверхня вкривається тонким шаром (плівкою) різних хімічних сполук (продуктів корозії): оксидів, хлоридів, сульфідів тощо. Інколи цей шар такий щільний, що крізь нього не може проникати агресивне середовище. В таких випадках з часом швидкість корозії зменшується, а то й зовсім припиняється. Наприклад, алюміній в атмосфері повітря кородує значно повільніше від заліза, хоч за своїми хімічними властивостями він активніший від заліза. Це пояснюється тим, що поверхня алюмінію вкривається суцільною, досить щільною і міцною оксидною плівкою, яка ізолює метал від доступу кисню, а оксидна плівка заліза, навпаки, є крихкою і ламкою, містить багато пор і тріщин, через що кисень повітря крізь неї легко проникає до поверхні заліза, і тим обумовлюється безперервне його руйнування.
Електрохімічна корозія
Електрохімічна корозія більш поширена і завдає значно більшої шкоди, ніж хімічна. Вона виникає при контакті двох металів у середовищі водних розчинів електролітів. На відміну від хімічної електрохімічна корозія супроводжується переміщенням валентних електронів з одної ділянки металу на іншу, тобто виникненням місцевих електричних струмів внаслідок утворення на кородуючій поверхні так званих гальванічних пар.
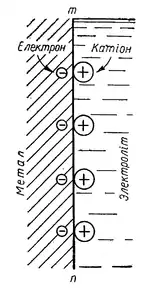
При зануренні цинкової пластинки в кислоту атоми цинку з її поверхні поступово переходять у розчин у вигляді іонів Zn2+, а їхні валентні електрони залишаються на поверхні металу. Внаслідок цього на границі метал—електроліт утворюється подвійний електричний шар. Внутрішню обкладку цього шару утворюють негативні заряди надлишкових електронів (позначених знаком —), а зовнішню обкладку — позитивні заряди іонів цинку (позначених знаком +). Внаслідок взаємного притягування протилежних зарядів іони цинку, що переходять у розчин, розміщуються поблизу поверхні металу. Нормальний електродний потенціал цинку складає -0,7618 в[5].
Подальший процес розчинення цинку стає можливим лише завдяки тому, що іони водню підходять до поверхні цинку і приєднують надлишкові електрони. При цьому іони цинку перестають утримуватись у подвійному електричному шарі негативними зарядами і вільно дифундують у глибину розчину, а на їх місце з поверхні металу переходять нові іони цинку і т. д. Таким чином, приєднання надлишкових електронів з поверхні металу іонами водню електроліту забезпечує безперервний перехід іонів цинку в розчин, тобто його розчинення, (кородування).
З цього виходить, що процес розчинення цинку в кислоті складається з двох паралельних процесів:
- з віддачі атомами цинку валентних електронів (окиснення цинку) і переходу іонів-цинку в розчин:
- (Метал) 2e ← Zn0 → Zn2+ (Розчин)
- і з приєднання надлишкових електронів іонами водню (відновлення іонів водню) і виділення вільного водню:
- (Метал) 2е + 2Н+ → 2Н° → Н2↑
Обидва ці процеси відбуваються на поверхні того самого металу — на цинковій пластинці. Але при певних умовах їх можна просторово роз'єднати. Так, коли поряд з цинковою пластинкою занурити в розчин мідну і обидві пластинки з'єднати металічним провідником, то перший процес (розчинення цинку) буде відбуватися на цинковій пластинці, а другий (відновлення іонів водню) — на мідній.
Мідь, як відомо, з розведеною сульфатною кислотою не взаємодіє. Тому іони міді не переходять у розчин і на її поверхні не буде надлишків електронів. Але коли обидві пластинки з'єднати мідною дротиною, то концентрація надлишкових електронів почне вирівнюватись на обох пластинках і електрони з цинкової пластинки почнуть переміщатися на мідну. Якщо в систему включити гальванометр, то він покаже наявність електричного струму. Однак концентрація електронів, на обох пластинках не може бути однаковою. Це пояснюється тим, що іони водню легше розряджаються (приєднують електрони) на поверхні міді, ніж на поверхні цинку. Через це процес відновлення іонів водню і виділення вільного водню буде відбуватися практично лише на мідній пластинці, а на цинковій; майже зовсім
припиниться. Але швидкість розчинення цинку при цьому значно збільшиться, оскільки надлишкові електрони, з поверхні цинку будуть швидко переміщатися на мідну пластинку і там приєднуватися іонами водню.
Приклад розчинення цинку, що перебуває в контакті з міддю, у розчині сульфатної кислоти є прикладом утворення і роботи гальванічних пар, які лежать в основі електрохімічної корозії. Гальванічні пари можна утворювати з будь-яких двох металів, які контактують між собою і занурені в розчин електроліту. При цьому швидкість кородування активнішого металу значно збільшується, а менш активний метал зовсім не кородує. На ньому відбувається лише відновлення іонів водню тими електронами, що прибувають з поверхні активнішого металу.
Електрохімічна корозія металів виникає не тільки в присутності сильних, а й слабких електролітів і навіть тонкого шару вологи, якою вкриваються металічні конструкції в атмосфері повітря. Будучи дуже слабким електролітом, вода теж дисоціює, утворюючи іони Н+ і ОН−, хоч і в незначній кількості. Але при розчиненні в ній різних солей, що містяться в повітрі у вигляді пилу, і газів — CO2, SO2 і ін., концентрація різних іонів, у тому числі й іонів водню, збільшується і стає достатньою для виникнення і перебігу електрохімічної корозії.
Електрохімічна корозія у присутності вологи
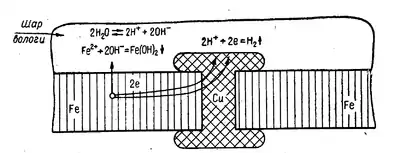
Прикладом електрохімічної корозії в присутності вологи, повітря є процес кородування залізної конструкції з мідними заклепками. Коли така конструкція вкривається шаром вологи (розчином електроліту), то залізні і мідні ділянки її поверхні утворюють гальванічні пари. При цьому атоми заліза як більш активного металу переходять у розчин у вигляді двовалентних іонів Fe2+, а втрачені ними валентні електрони переміщаються на мідь і там приєднуються катіонами водню, відновлюючи їх до вільного водню.
Процес кородування заліза в контакті з міддю схематично можна зобразити такими рівняннями:
- дисоціація води:
- втрата атомами заліза валентних електронів і перехід іонів у розчин:
- (Метал) 2е ← Fe0 → Fe2+ (Розчин)
- відновлення катіонів водню (на поверхні міді) і виділення вільного водню:
- утворення дигідроксиду заліза:
- окиснення двовалентного заліза до тривалентного розчиненим киснем повітря:
- часткова втрата води тригідроксидом заліза і перетворення його в гідроксид-оксид заліза:
В результаті цих реакцій залізо вкривається шаром іржі, яка складається головним чином з FeO(OH), а також з гідроксидів заліза Fe(OH)2 і Fe(OH)3.
Гальванічні пари на кородуючій поверхні можуть утворюватись не лише при контакті двох металів з великими поверхнями, а й при контакті основного металу з нерозчинними в ньому домішками інших металів, які завжди містяться в технічних металах. У таких випадках на кородуючій поверхні металу утворюється безліч невеликих за розмірами так званих мікрогальванічних пар, роботою яких обумовлюється електрохімічне кородування основного металу.
Як при контакті двох різних металів (утворенні макрогальванічних пар), так і при наявності в основному металі нерозчинних домішок інших металів (утворенні мікрогальванічних пар) потік електронів (електричного струму) спрямований від більш активного металу до менш активного. Більш активний метал кородує (руйнується), а менш активний не кородує. На ньому лише відновлюються іони водню тими електронами, що прибувають від атомів

активнішого металу.
Швидкість електрохімічної корозії тим більша, чим більше утворюється на кородуючій поверхні гальванічних пар, тобто чим більше є контактів основного металу з іншими менш активними металами або чим більше він забруднений домішками менш активних металів. Чим чистіший метал, тим менше він піддається корозії, а дуже чисті метали майже зовсім не кородують.
Швидкість електрохімічної корозії залежить також від різниці активності металів, що утворюють гальванічні пари. Чим більш віддалені ці метали один від одного в електрохімічному ряді напруг, тим більша швидкість корозії. На швидкість корозії впливає також електроліт і температура. Чим сильніший електроліт, тобто чим більше міститься в ньому іонів, зокрема іонів водню, і чим вища температура, тим більша швидкість електрохімічної корозії.
Біокорозія
Біокорозія — корозія, спричинена мікроорганізмами або продуктами їх життєдіяльності.
Мікробна корозія, або широко відома як мікробіологічно обумовлена корозія, є корозією, спричиненою або утвореною за сприяння мікроорганізмів, як правило, хемоавтотрофів. Це поняття може застосовуватися як до металевих, так і до неметалевих матеріалів, за наявності або відсутності кисню. Сульфат-редукційні бактерії активні за відсутності кисню (анаеробні); вони виробляють сірководень, та викликають розтріскування сульфіду. У присутності кисню (аеробного) деякі бактерії, можуть безпосередньо окиснювати залізо до оксидів та гідроксидів заліза, інші бактерії окислюють сірку і виробляють сірчану кислоту, що викликає біогенну сульфідну корозію. Скупчені осередки, можуть утворюватися у відкладеннях корозійних продуктів, що призводить до локальної корозії.
Стрімка корозія «низької води», є особливо агресивною формою, яка впливає на сталеві палі у морській воді біля позначки припливу. Вона характеризується рудим осадом, який тхне сірководнем у разі обробки кислотою. Швидкість корозії може бути дуже високою, і впродовж невеликого часу здатна перевищити проектні корозійні показники, що призведе до дострокового зносу сталевих паль. Палі, які були покриті та мають катодний захист, встановлений під час будівництва, не піддаються такій корозії. Для незахищених паль, місцево, може бути встановлено захисні аноди на постраждалих ділянках, щоби придушити корозію, або може бути встановлена повна осучаснена захисна анодна система. Пошкоджені ділянки, можна також обробляти за допомогою катодного захисту, з використанням витратних анодів або з застосуванням струму для неактивного аноду задля отримання вапняного осаду, що допоможе захистити метал від подальшого руйнування.
Ерозійна корозія
Спеціальний тип неоднорідної корозії пасивних металів, при якій утворюються заглиблення(ямки), що звичайно
відбувається в присутності деяких йонів за певного позитивного електродного потенціалу відносно критичного потенціалу утворення ямок та горбиків.
Корозія полімерів
Під деградацією полімерів, мається на увазі кілька складних і часто погано розпізнаних фізико-хімічних процесів. Вони разюче відрізняються від інших обговорюваних тут явищ, отже, термін «корозія» може застосовуватися до них, лише опосередковано. Через велику молекулярну вагу, може бути досягнуто дуже малої ентропії, шляхом змішування заданої маси полімеру з іншою речовиною, що робить їх, як правило, важко розчинними. У той час як розчинення є проблемою у деяких полімерних застосуваннях, його відносно просто розробити.
Більш поширеною та пов'язаною з цим вадою, є «набухання», де невеликі молекули просочуються до структури, зменшують міцність та жорсткість і викликають зміну обсягу. І навпаки, багато полімерів (особливо гнучких вінілів) навмисно роздувають пластифікаторами, які можуть вилуговуватися зі структури, та викликати крихкість або інші небажані зміни.
Найбільш поширеним видом деградації, однак, є зменшення довжини ланцюга полімеру. Механізми, які розривають полімерні ланцюги, знайомі біологам через їх вплив на ДНК: іонізуюче випромінювання (найчастіше ультрафіолетове випромінення), вільні радикали та окисники, такі як кисень, озон і хлор. Розтріскування озоном — відома проблема, що впливає, наприклад, на природний каучук. Пластичні добавки можуть дуже ефективно сповільнювати цей процес і здатні бути настільки ж простими, як ультрафіолетові поглинальні пігменти (наприклад, діоксид титану або сажа). Пластикові сумки часто не містять ці добавки, для легшого розкладання.
Боротьба з корозією
Корозія металів завдає величезних збитків господарству. Внаслідок корозійного руйнування втрачається близько 10 % щорічного видобутку металів. Тому заходам боротьби з корозією приділяється значна увага. Способів боротьби з корозією багато і вони досить різноманітні.
Одним з найпоширеніших способів боротьби з корозією є покриття металу (головним чином заліза) масляними фарбами. Захисна дія фарби ґрунтується на тому, що оліфа, піддаючись полімеризації, утворює на поверхні металу суцільну еластичну плівку, яка ізолює метал від дії атмосферних хімічних агентів. Інколи для захисту металу від корозії (наприклад, алюмінію і деяких сталевих виробів) штучно створюють оксидну плівку обробкою їх поверхні сильними окисниками.
Використовуються також стійкі до абразивного зношування ліофобні поліуретанові покриття.
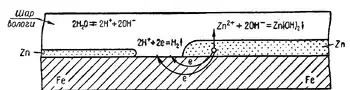
Значного поширення одержав також спосіб покриття одного металу іншим. Наприклад, дахове залізо покривають тонким шаром цинку. З цією метою залізні листи занурюють на короткий час у розплавлений цинк. Сам по собі цинк в атмосфері повітря не піддається корозії, оскільки на його поверхні утворюється досить стійка захисна оксидна плівка ZnO. При пошкодженні цинкового шару (тріщини, подряпини тощо) цинк з залізом у присутності вологи повітря утворює гальванічну пару. При цьому електрохімічному корозійному руйнуванню піддається цинк як активніший метал, а залізо не руйнується доти, поки не буде зруйнований весь захисний шар цинку. Конкуренцію традиційному цинкуванню складає покриття сталевих листів алюцинком.
На цьому ж принципі ґрунтується і так званий протекторний спосіб захисту металів від корозії. Суть цього способу полягає в тому, що металеву конструкцію сполучають металічним провідником з активнішим металом, який піддається корозійному руйнуванню. Наприклад, у парові котли інколи вводять листи цинку, які сполучають залізними стержнями з стінками котла. При цьому утворюється в середовищі води гальванічна пара, внаслідок чого цинк, як активніший метал руйнується, а залізні стінки котла не піддаються корозії. Так само можна захищати і підземні трубопроводи.
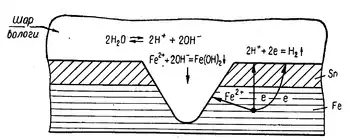
Інколи металеві вироби вкривають захисним шаром менш активного металу. Прикладом цього може служити біла жерсть, з якої виробляють консервні банки. Її одержують зануренням на короткий час залізних листів у розплавлене олово. Олово дуже добре захищає залізо доти, поки його шар суцільний. Але коли захисний шар пошкоджується і залізо приходить у дотик з агресивним середовищем, воно з оловом утворює гальванічну пару і залізо як активніший метал піддається корозійному руйнуванню. При цьому залізо кородує значно скоріше, ніж у тому випадку, коли воно не вкрите шаром олова.
Досить поширеним є гальванічний спосіб покриття одного металу іншим (шляхом електролізу). Цим способом покривають нікелем (нікелювання), хромом (хромування), міддю (міднення), сріблом (сріблення), золотом (золочення) і іншими металами. Гальванічним способом можна наносити дуже тонкий і рівномірний шар захисного металу. Гальванічні покриття не тільки захищають металічні вироби від корозії, а й надають їм гарного зовнішнього вигляду.
Для боротьби з корозією в середовищі рідин застосовують спеціальні добавки, так звані інгібітори, тобто сповільнювачі корозії. Інгібіторами можуть бути різні речовини: хромат натрію, дихромат калію, фосфат натрію тощо, а також желатин, клей та інші органічні речовини. Інгібітори сприяють утворенню на кородуючій поверхні металу міцної захисної плівки, внаслідок чого швидкість корозії може зменшуватись у десятки і сотні разів. Особливо важливу роль відіграють інгібітори при взаємодії металів з кислотами. Так, наприклад, коли додати деякі інгібітори до хлоридної кислоти, то її можна зберігати в сталевій тарі, хоч хлоридна кислота з залізом взагалі реагує досить жваво.
Крім того, останнім часом стали широко застосовувати сплави з високими антикорозійними властивостями. Такі сплави одержують шляхом добавок до основного металу інших металів — нікелю, кобальту, хрому і ін. Прикладом антикорозійних сплавів може служити сталь із вмістом 15—20 % Со. Така сталь цілком стійка до дії кислот. З неї виготовляють різну хімічну апаратуру.
Див. також
Примітки
- Физическая химия. с. 255. ISBN 5-211-03516-X.
- Шлугер М.А. - Гальваническое покрытия в машиностроени, т.1.
- М.И.Гольдштейн - Специальные стали, с.258.
- А.А.Герасименко - Защита от коррозии,старения и биоповреждений машин, оборудования и сооружений.
- В.П.Живописцев, Е.А.Селезнева - Аналитическая химия цинка, с.11.
Джерела
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
- В. І. Алімов, З. А. Дурягіна. Корозія та захист металів від корозії. Донецьк-Львів: ТОВ «Східний видавничий дім». — 2012. — 328 с.
- П. М. Сопрунюк, В. М. Юзевич. Діагностика матеріалів і середовищ. Енергетичні характеристики поверхневих шарів. — Львів: ФМІ ім. Г. В. Карпенка НАН України, вид-во «СПОЛОМ». — 2005. — 292 с.
- Коррозия и защита металлов / М. А. Шиндер, Ф. Ф. Ашогин, Е. А. Ефимов. — М.: Металлургия, 1981. — 358 с.
- Corrosion-Resistant Lined Pump and Compressor Pipe / N. A. Bogatov, A. A. Bogatov and D. R. Salikhyanov // Steel in Translation. — 11, 2014. — Vol. 44. — pp. 867—869.
- Похмурський В. І., Хома М. С. Корозійна втома металів та сплавів. Монографія. — Львів: СПОЛОМ, 2008. — 304 с.
Посилання
- Корозія; Корозія бетону; Корозія будівельного матеріалу під напругою // Термінологічний словник-довідник з будівництва та архітектури / Р. А. Шмиг, В. М. Боярчук, І. М. Добрянський, В. М. Барабаш ; за заг. ред. Р. А. Шмига. — Львів, 2010. — С. 112-113. — ISBN 978-966-7407-83-4.
- КОРО́ЗІЯ //ЕСУ

