Альфа-Аманітин
альфа-аманітин або α-аманітин, один з відомих аманітинів, циклічний пептид з восьми амінокислот. Цілком ймовірно, що він є найсмертельнішим з усіх аматоксинів, токсинів, що містяться в кількох видах грибів роду Amanita, серед яких бліда поганка (Amanita phalloides), мухомор білий смердючий, і декілька подібних їм видів, передусім A. virosa та A. bisporigera. Альфа-аманітин міститься також в грибах Galerina marginata та Conocybe filaris. LD50 (середня смертельна доза) для щурів, при пероральному вживанні аманітину дорівнює приблизно 0.1 мг/кг.

Структура цього поліпептиду є нетиповою зпосеред більшості поліпептидів, це пов’язано з розгалуженням амінокислотного ланцюга. Поперечний місток між 6-гідрокси-триптофаном та цистеїном утворює друге "внутрішнє кільце", як видно на структурній формулі сполуки. "Зовнішнє кільце" сформоване звичайними пептидними зв’язками амінокислотного ланцюга.
На відміну від більшості циклічних пептидів, аматоксини (та фалотоксини) синтезуються в рибосомах. Хізер Голлен (Heather Hallen) та Джонатан Волтон (Jonathan Walton) з Універститету штату Мічиган, першими виділили ген, який кодує властивості α-аманітину та фалацидину (одного з фалотоксинів).[1]
Наукове значення
α-аманітин є селективним інгібітором РНК-полімерази ІІ та ІІІ.[2] Ця властивість робить сполуку сметрельним токсином.
α-аманітин можна використовувати для визначення типу РНК полімерази. Для цього вивчають чутливість полімерази в присутності α-аманітину. РНК-полімераза I не є чутливою до токсину, РНК-полімераза II є надзвичайно чутливою (пригнічується при концентрації 1мкг/мл), РНК-полімеразам III та IV властива середня та незначна чутливість, концентрації пригнічення 10 та 50 мкг/мл відповідно.
Симптоми отруєння
α-Аманітин має надзвичайно сильне та специфічне тяжіння до ферменту РНК-полімераза II. Потрапляючи в клітини печінки, він зв’язуєтья з РНК-полімеразою II, спричиняючи цитоліз гепатоцитів (клітин печінки).[3] Протягом перших 10 годин проявляється дуже мало симптомів; зазвичай важкі прояви з’являються лише по 24 годинах після потрапляння токсину в організм. Така затримка в появі ефектів робить діагностику отруєння α-аманітином важкою, а саме отруєння надзвичайно небезпечним. На час появи симптомів отруєння промивання шлунку є безрезультативним і відтак безсенсовним. Діарея та судоми є першими проявами, проте вони незабаром проходять, створюючи оманливе враження ремісії. Як правило на 4 або 5 день починають проявлятися важкі ефекти дії токсину на печінку та нирки, що закінчується повною відмовою обох органів. Смерть як правило наступає приблизно через тиждень після отруєння.[4]
Близько 15% отруєних помирають протягом 10 днів, а стан хворих розвивається від коматозного стану до ниркової недостатності, печінкової недостатності, печінкової коми, дихальної недостатності та смерті. Особи, які виживають мають високий ризик незворотного ушкодження печінки та нирок.[5] Діагностика є ускладненою, і базується на спостереженні клінічних синдромів та наявності альфа-аманітину в сечі. В більшості випадків аналіз сечі є найбільш важливим протягом 48 годин від вживання отрути.
Лікування в основному зводиться до підтримуючої терапії (промивання шлунку, активоване вугілля, переливання та підтримка водно-сольового балансу), можливе також застосування кількох агентів, що можуть зменшити вплив аматоксинів, включаючи внутрішньовенозне введення похідних пеніциліну та цефалоспорину. У випадках важкого отруєння задля врятування життя може знадобитися трансплантація печінки. Найнадійніший спосіб лікування отруєння аманітином це промивання шлунку одразу після вживання їжі, що могла містити токсин, проте на час розвитку симптомів робити це вже надто пізно. Для лікування отруєння аманітином, зокрема в результаті вживання в їжу блідої поганки, використовують також внутрішновенні ін'єкції силібініну, у формі силібінін-С-2',3-дигідросукцинат динатрієвої солі, (торгова назва Легалон SIL)[6], який використовується для лікування тяжких інтоксикацій гепатотоксичними препаратами такими як, наприклад, парацетамол.[7]
Механізм пригнічувальної дії
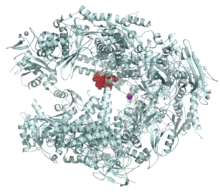
Зв'язуючись з молекулою РНК-полімерази II, альфа-аманітин порушує процес транслокації молекул РНК та ДНК, необхідний для початку нового циклу синтезу РНК. Присутність α-аманітину може зменшувати швидкість переміщення РНК-полімерази II на ДНК з кількох тисяч до кількох одиниць нуклеотидів на хвилину,[9][10] проте не знижує афінність ферменту до трифосфату нуклеозидів,[11] і не блокує можливість утворення фосфодиефірного зв'язку.[12][13] Зв’язування α-аманітину з РНК-полімеразою унеможливлює мобільність ферменту, знижуючи швидкість переміщення ферменту по ланцюгу ДНК, результатом чого є блокування синтезу матричних РНК і припинення синтезу білків клітиною.
Використання в коньюгатах ліки-антитіло
Фармацевтична компанія Heidelberg Pharma, GmbH, головний офіс якої міститься в Ладенбурзі, Німеччина, що займається доклінічним пошуком та розробкою лікарських засобів, розробила новий коньюгат ліки-антитіло або ADC-технологію (ADC від англійського Antibody-Drug Conjugate) на основі α-аманітину. В пікомолярних концентраціях ADC на основі аманітину показав суттєву активність, щодо стійких до лікування клітин пухлин.[14]
Схоже, що унікальний механізм дії α-аманітину робить коньюгати з антитілами на його основі придатними токсичними агентами. Переносимість та терапевтичний діапазон коньюгатів на основі аманітину вивчено на моделях різних гризунів та приматів. Оскільки аманітин є водорозчинним його коньюгати з антитілами мають меншу тенденцію до агрегації, навіть за відносно високих концентрацій токсину до антитіл.[15][16]
В доклінічних дослідженнях раку простати мишей α-аманітин, прив'язаний до антитіла спрямованого проти специфічного простаті мембранного антигена (PSMA; FOLH1; GCPII), демонстрував високу протипухлинну активність та спричиняв повну ремісію після одноразового інтравенозного введення в дозах токсину 150 μг/кг. Також, аманітинові коньюгати з використанням антитіл anti-Her2 демонстрували високу протипухлинну активність у серії експериментальних онкологічних досліджень, метою яких було визначення дієвості цих сполук в лікуванні раку грудей HER2+. Пригнічення зв'язаної з аманітином РНК-полімерази II спричиняє апоптоз не лише клітин, що швидко діляться, але й клітин, що діляться повільно, що часто спостерігається у випадках раку простати.[17][18]
Застереження
Наведені у цій статті відомості, щодо експериментів з розробки потенційних протиракових агентів на основі альфа-аманітину не є свідченнями чи підтвердженнями, і не мають розглядатися як свідчення чи підтвердження можливої ефективності лікування онкологічних станів з використанням будь-яких мухоморів чи будь-яких засобів на їх основі. Йдеться лише про суто експериментальні розробки, ефективність яких ще має бути перевірена на людських моделях, і які можуть, або не можуть завершитися розробкою ліків.
Варто пам'ятати, що альфа-аманітин, як і всі аманітини та аматоксини, є дуже небезпечними для життя та здоров'я людини сполуками, а вживання грибів, що містять аматоксини, чи будь-яких продуктів на їхній основі, становить серйозну загрозу життю.
Див. також
Джерела
- H. Hallen; H. Luo; J.S. Scott-Craig; J.D. Walton (2007).
- B. Meinecke; S. Meinecke-Tillmann (1993).
- D. Michelot; R. Labia (1988). "alpha-Amanitin: a possible suicide substrate-like toxin involving the sulphoxide moiety of the bridged cyclopeptide."
- A. Mas (2005).
- Benjamin DR.
- Нормативно-директивні документи МОЗ України. Інструкція до застосування Легалон SIL. mozdocs.kiev.ua. Процитовано 28 листопада 2016.
- Mitchell, T (2009).
- Bushnell, D. A.; Cramer, P; Kornberg, RD (Feb 2002).
- Chafin, D. R.; Guo, H.; Price, D. H. (1995).
- Rudd, M. D.; Luse, D. S. (1996).
- Cochet-Meilhac, M.; Chambon, P. (1974).
- Vaisius, A. C.; Wieland, T. (1982).
- Gu, W.; Powell, W.; Mote, J. Jr. & Reines, D. (1993).
- Alpha-amanitin.
- Moldenhauer G, Salnikov AV, Lüttgau S, Herr I, Anderl J, Faulstich H. Therapeutic potential of amanitin-conjugated anti-epithelial cell adhesion molecule monoclonal antibody against pancreatic carcinoma.
- Hechler T, Kulke M, Müller C, Pahl A, Anderl J. Amanitin-based antibody-drug conjugates targeting the prostate-specific membrane antigen PSMA.
- Hechler T, Kulke M, Müller C, Pahl A, Anderl J. Amanitin-based ADCs with an improved therapeutic index.
- Anderl J, Faulstich H, Hechler T, Kulke M. Antibody–Drug Conjugate Payloads.