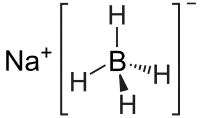
Борогідрид натрію
Борогідри́д на́трію, те́трагі́дробора́т на́трію — це неорганічна сполука з хімічною формулою NaBH4. За нормальних умов це безбарвні кристали, які добре розчиняються у воді і полярних органічних розчинниках. Натрію борогідрид широко використовується у лабораторному органічному синтезі та промисловості як відновлюючий агент.[2]
| Борогідрид натрію | |
|---|---|
 | |
 | |
| Систематична назва | Натрій тетраборогідрид |
| Інші назви | Тетрагідроборат натрію |
| Ідентифікатори | |
| Номер CAS | 16940-66-2 |
| Номер EINECS | 241-004-4 |
| ChEBI | 50985 |
| RTECS | ED3325000 |
| SMILES |
[Na+].[BH4-] |
| InChI |
InChI=1S/BH4.Na/h1H4;/q-1;+1 |
| Номер Гмеліна | 23167 |
| Властивості | |
| Молекулярна формула | NaBH4 |
| Молярна маса | 37,83 г/моль |
| Зовнішній вигляд | біла речовина |
| Густина | 1,0740 г/см³ |
| Тпл | 400 °C[1] |
| Ткип | 500 °C (розкл.)[1] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Борогідрид натрію був відкритий в 1940-их роках Германном Шлезінгером, котрий в той час очолював роботу лабораторії, яка розробляла борогідриди металів для воєнних цілей.[3] Результати роботи цієї лабораторії були опубліковані лише в 1953 році.
Отримання
Борогідрид натрію можна отримати кількома способами:
- метод, відкритий Шлесінгером — реакція гідриду натрію та триметоксибору:
- нагріванням суміші натрію (або гідриду натрію) та оксиду бору:
- при взаємодії гідриду натрію та диборану:
Хімічні властивості
Борогідрид натрію розкладається під дією води та розчинів кислот:
На повітрі борогідрид окиснюється:
Нуклеофільні властивості
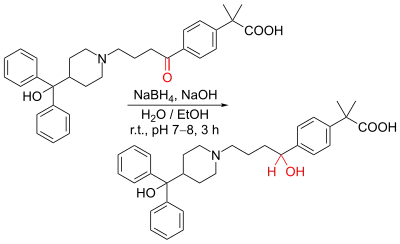
NaBH4 проявляє сильні відновні властивості, він може відновлювати кетони, альдегіди, хлорангідриди карбонових кислот, тіоестери та іміни, а також подвійний зв'язок в 1,2-заміщених нітроетиленах з отриманням як продукту реакції 1,2-заміщених нітроалканів (в основному синтез проводять в спиртовому середовищі).
В борогідридному аніоні σ-зв'язок В-Н є нуклеофільним, оскільки електрони цього зв'язку займають HOMO. Найнижчою незаповненою молекулярною орбіталлю (LUMO) електрофіла (карбонільної сполуки) є π*-орбіталь подвійного С=О зв'язку. Тому пара електронів зв'язку В-Н атакує π*-орбіталь карбонільної сполуки розриваючи π-зв'язок С=О. У результаті утворюється інтермедіат оксианіон. Оскільки реакція в основному проводиться у воді, оксіаніон протонується через трансфер протону з утворенням гідроксильного замісника.[4]
Застосування
Борогідрид натрію широко використовується у лабораторному органічному синтезі та хімічній промисловості як відновлюючий агент.
Примітки
- MSDS data (carl roth)
- Banfi, L.; Narisano, E.; Riva, R.; Stiasni, N.; Hiersemann, M. «Sodium Borohydride» in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289X.rs052.
- Schlesinger, H. I.; Brown, H. C.; Abraham, B.; Bond, A. C.; Davidson, N.; Finholt, A. E.; Gilbreath, J. R.; Hoekstra, H.; Horvitz, L.; Hyde, E. K.; Katz, J. J.; Knight, J.; Lad, R. A.; Mayfield, D. L.; Rapp, L.; Ritter, D. M.; Schwartz, A. M.; Sheft, I.; Tuck, L. D.; Walker, A. O. (1953). New developments in the chemistry of diborane and the borohydrides. General summary. J. Am. Chem. Soc. 75: 186–90. doi:10.1021/ja01097a049.
- Clayden J., Greeves N., Warren S. Organic chemistry. — 2nd ed. — Oxford University Press, 2012. — ISBN 978-0-19-927029-3.
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Реми Г. Курс неорганической химии / А. В. Новоселова. — М. : ИИЛ, 1963. — Т. 1. — 922 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Р. А. Лидин. — 3-е. — М. : Химия, 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Clayden J., Greeves N., Warren S. Organic chemistry. — 2nd ed. — Oxford University Press, 2012. — ISBN 978-0-19-927029-3.