Галогенкарбонові кислоти
Галогенкарбонові кислоти — це карбонові кислоти, які містять один або декілька атомів галогену у радикалі. Наприклад, хлороцтова кислота Cl—CH2—COOH.
Отримання
Галогенкарбонові кислоти отримують галогенуванням карбонових кислот. Для отримання трифлуороцтової кислоти застосовують HF, при цьому відбувається електроліз:
При хлоруванні та бромуванні застосовують PCl3 та PBr3. Спочатку утворюються галогенангідриди, потім до них приєднується галоген, а потім вони взаємодіють з кислотами, які ще не прореагували. При цьому утворюються α-галогенкарбонові кислоти:
Для отримання β-галогенкарбонових кислот галогеноводні приєднують до ненасичених карбонових кислот. Ця реакція відбувається всупереч правилу Марковникова:
Хімічні властивості
Галогенкарбонові кислоти є сильнішими кислотами, ніж карбонові, внаслідок негативного I-ефекту галогенів. Також вони мають більшу реакційну здатність у реакціях нуклеофільного заміщення галогенів через карбонільну групу.
Реакції за участі атома галогену
Галогенкарбонові кислоти легко вступають у реакції нуклеофільного заміщення. Вони можуть вступати у реакції зі слабкими нуклеофілами, як-от вода:
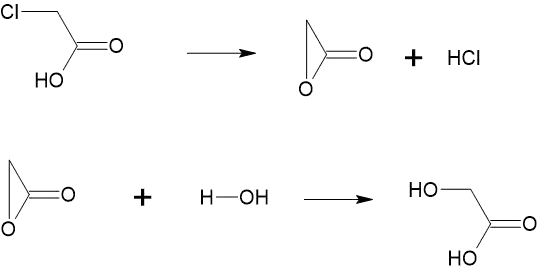
Механізм такої реакції для α-галогенкарбонових кислот такий: спочатку відщеплюється галогеноводень. Від карбоксильної групи відщеплюється протон, а від атома карбону — негативний іон галогену. При цьому між негативним атомом оксигену з карбоксильної групи та позитивним атомом карбону утворюється зв'язок. Потім негативний іон нуклеофілу приєднується до атома карбону, а протон — до атома оксигену.
За таким механізмом можуть взаємодіяти і з аміаком, утворюючи амінокислоти. Останні вступають в реакцію нейтралізації з іншим продуктом реакції — галогеноводнем:
Галогенкарбонові кислоти також можуть вступати у реакцію дегідрогалогенування — відщеплення галогеноводню з утворенням ненасичених карбонових кислот:
Насправді вони спочатку вступають у реакцію нуклеофільного заміщення, а потім дегідратуються:
Реакції за участі карбоксильної групи
Галогенкарбонові кислоти є сильнішими кислотами, ніж просто карбонові. З основами утворюють солі, зі спиртами — естери:
α-галогенкарбонові кислоти (особливо ди- та три-заміщені) при нагріванні здатні до декарбоксилювання. При цьому утворюється галогеналкан (або галогеналкен чи галогеналкін) та вуглекислий газ:
Література
Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.