Солі (хімія)
Со́лі — хімічні речовини іонної будови, до складу яких входять кислотні залишки (аніони), поєднані з катіонами різного походження (атоми металів, металоподібні групи, як NH+4, та ін.). Утворюються солі внаслідок реакції нейтралізації кислот та основ. Як правило, солі є кристалічними речовинами. Найпростіший приклад солі — кухонна сіль, хімічна формула якої — NaCl.

Номенклатура
Існує кілька способів утворення назв солей. Найпростіше утворювати назви солей, як і кислот, від міжнародних назв кислотних залишків. При цьому назви солей кисневих кислот, коли кислототвірний елемент має найвищу валентність, закінчуються на -ат. Наприклад:
- KNO3 — нітрат калію (азотнокислий калій)
- CaSO4 — сульфат кальцію (сірчанокислий кальцій),
- Na3PO4 — фосфат натрію (фосфорнокислий натрій),
- BaCO3 — карбонат барію (вуглекислий барій),
- Na2SiO3 — силікат натрію (кремнекислий натрій) і т. д.
Назви солей безкисневих кислот мають закінчення -ид або -ід. Наприклад: MgCl2 — хлорид магнію, KI — йодид калію, NaBr — бромід натрію, Na2S — сульфід натрію і т. д.
Якщо метал, що входить до складу солі, проявляє різну валентність і утворює з тим самим кислотним залишком кілька солей, то для їх розпізнавання треба вказувати число кислотних залишків у молекулі солі, або валентність металу. Коли кислотний залишок одновалентний, то звичайно вказують число кислотних залишків шляхом додавання до назви аніону префікса з грецьких числівників. Наприклад: CuCl — монохлорид міді, CuCl2 — дихлорид міді і т. д.
Коли ж кислотний залишок дво- або тривалентний, тоді вказують валентність металу, позначаючи її римською цифрою в дужках після назви металу. Наприклад: Cu2SO4 — сульфат міді (І), CuSO4 — сульфат міді (II), Fe2(SO4)3 — сульфат заліза (III) і т. д.
В назвах кислих солей додають префікс гідро- або дигідро-. Наприклад: NaHSO4 — гідросульфат натрію, NaH2PO4 — дигідрофосфат натрію, CaHPO4 — гідрофосфат кальцію, Ca(H2PO4)2 — дигідрофосфат кальцію і т. д.
Назви основних солей утворюють з назви кислотного залишку і слова гідроксид або дигідроксид. Наприклад: AlOHSO4 — сульфат-гідроксид алюмінію, Al(OH)2CH3COO — ацетат-дигідроксид алюмінію, Cu2(OH)2CO3 — карбонат-дигідроксид міді (II) і т. д.
Крім того, деякі солі мають ще свої особливі назви: Na2CO3 — сода, K2CO3 — поташ, AgNO3 — ляпіс, NaNO3 — чилійська селітра, Cu2(OH)2СО3 — малахіт тощо.
Реакції утворення солей
1. При заміщенні атомів Гідрогену в молекулах кислот на атоми металів:
- Zn + 2HCl → ZnCl2 + H2
- 2 CH3COOH + Mg → Mg(CH3COO)2 + H2
2. При обміні гідроксильних груп у молекулах основ на кислотні залишки молекул кислот. Суть цієї реакції полягає в обміні атомів Гідрогену в молекулі кислоти на атоми металу молекули основи (з такою ж самою вірогідністю відбувається обмін гідроксильних груп молекул основ на кислотні залишки молекул кислот), внаслідок чого утворюються сіль і вода (реакція нейтралізації):
- HCl + NaOH → NaCl + H2O
- CH3COOH+ NaOH → CH3COONa + H2O
3. При взаємодії кислот з оксидами:
- 2HCl + CuO → CuCl2 + H2O
- 3H2SO4 + Al2O3 → Al2(SO4)3 + 3H2O
4. При взаємодії кислот з солями:
- 3H2SO4 + Ca3(PO4)2 → 2H3PO4 + 3CaSO4 ↓
5. При взаємодії основ з кислотними оксидами:
- 2KOH + CO2 → K2CO3 + H2O
6. При взаємодії основ з солями:
- 2NaOH + CuCl2 → 2NaCl + Cu(OH)2 ↓
7. При взаємодії основних оксидів з кислотними:
- CaO + CO2 → CaCO3
8. При взаємодії солей:
- K2SO4 + BaCl2 = 2KCl + BaSO4 ↓
9. При взаємодії солей з металами:
- CuSO4 + Zn → ZnSO4 + Cu
10. При взаємодії металів з неметалами:
- Mg + Cl2 → MgCl2
Існують також інші способи одержання солей.
Не кожним з перелічених способів можна одержати будь-яку сіль. Кислі солі утворюються звичайно при взаємодії нормальної солі з однойменною кислотою. Наприклад:
- BaCO3 + H2CO3(СО2 + Н2О) = Ba(HCO3)2
- Ca3(PO4)2 + H3PO4 = 3CaHPO4
Основні солі утворюються найчастіше при взаємодії солі з відносно невеликими кількостями лугу. Наприклад:
- CuCl2 + NaOH = Cu(OH)Cl ↓ + NaCl
- AlCl3 + NaOH = Al(OH)Cl2 ↓ + NaCl
- AlCl3 + 2NaOH = Al(OH)2Cl ↓ + 2NaCl
Класифікація
Є декілька способів класифікації солей:
- За кислотою, якій відповідає ця сіль (хлориди, фосфати, нітрати)
- За середовищем : Середні (нормальні) солі, Кислі солі, Основні солі
Середні солі
Якщо всі кислотні атоми Гідрогену в молекулах кислот обмінені чи заміщені на атоми металів або усі гідроксильні групи в молекулах основ обмінені на кислотні залишки молекул кислот, такі солі називаються нормальними, або середніми, або просто солями. Наприклад,
- 2CH3COOH + Mg(ОН)2 = Mg(CH3COO)2 + 2H2O
- Н2SO4 + Mg = MgSO4 + H2
Виходячи з теорії електролітичної дисоціації, солями називаються складні речовини, які у водному розчині дисоціюють на катіони металів і аніони кислотних залишків. Нормальні солі ніяких інших катіонів і інших аніонів не утворюють:
- KCl (aq) K+(aq) + Cl−(aq)
- Al2(SO4)3 (aq) 2 Al3+(aq) + 3 SO2−4 (aq)
Кислі солі
Якщо тільки частина кислотних атомів Гідрогену молекул кислот обмінена або заміщена на атоми металів, такі солі називають кислими, або гідросолями. Наприклад:
- NaOH + H2SO4 = NaHSO4 + H2O
- Ca(OH)2 + H3PO4 = CaHPO4 + 2H2O
Кислі солі у водному розчині дисоціюють на катіони металів, катіони Гідрогену і аніони кислотних залишків. Таким чином, кисла сіль ніби одночасно є і сіллю, оскільки при дисоціації вона утворює катіони металів, і кислотою, бо одночасно утворює і катіони Гідрогену:
- NaHSO4 (aq) Na+(aq) + H+(aq) + SO2−4 (aq)
- CaHPO4 (aq) Ca2+(aq) + H+(aq) + PO3−4 (aq)
Іони Гідрогену кислої солі при взаємодії її з основою теж можуть обмінюватись на іони металу з- утворенням нормальної солі і води:
- NaHSO4 + NaOH = Na2SO4 + H2O
Основні солі
Якщо тільки частина гідроксильних груп у молекулах основ обмінена на кислотні залишки молекул кислот, то такі солі називають основними:
- Cu(OH)2 + HCl = Cu(OH)Cl ↓ + H2O
- Fe(OH)3 + H2CO3 = Fe(OH)CO3 ↓ + 2H2O
- 2Cu(OH)2 + H2CO3 = Cu2(OH)2CO3 ↓ + 2H2O
Основні солі у водному розчині дисоціюють на катіони металу і аніони гідроксилу і кислотні залишки. Таким чином, основна сіль ніби одночасно є і сіллю, оскільки вона утворює при дисоціації аніони кислотних залишків, і основою, бо утворює і гідроксид-аніони:
- Cu(OH)Cl Cu2+(aq) + OH−(aq) + Cl−(aq)
- Fe(OH)CO3 Fe3+(aq) + OH−(aq) + CO2−3 (aq)
Обидві ці солі у воді практично нерозчинні, але розчинна їх частина дисоціює, за наведеними рівняннями. Іони гідроксилу основної солі при взаємодії її з кислотою теж можуть обмінюватись на кислотні залишки з утворенням нормальної солі:
- Cu(OH)Cl + HCl = CuCl2 + Н2О
Будова
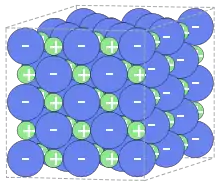
В твердому стані більшість солей утворюють іонні кристали, у вузлах кристалічної ґратки яких знаходяться катіони та аніони. В рідкому (розплавленому) стані солі більшості сильних кислот і основ перебувають у рівновазі між іонною дисоційованою формою та недисоційованою молекулярною. Чим сильнішою є кислота та основа, що утворили сіль, тим більше така рівновага зміщена в сторону іонної форми.
Структурні формули
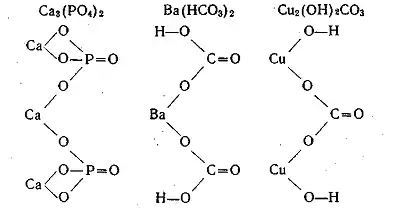
Більшість солей є іонними сполуками і використання структурних формул для них є некоректним, оскільки хибно передає будову речовини. Тим не менше, у навчальних цілях інколи умовно зображають структурні формули солей з ковалентними зв'язками між атомами. В таких випадках виходять з формул відповідних кислот або основ, заміняючи в них кислотні атоми Гідрогену на атоми металу або гідроксильні групи основ на кислотні залишки. Для прикладу наведемо структурні формули фосфату кальцію, гідрокарбонату барію і основного карбонату міді:
Властивості
Усі солі являють собою тверді кристалічні речовини. Щодо нагрівання деякі солі є досить стійкими. Наприклад, NaCl, KCl, Na2SO4 та деякі інші можна нагрівати до температури їх плавлення і навіть кипіння, і вони не розкладаються. Інші ж солі є нестійкими й при нагріванні вони розкладаються, не плавлячись. Наприклад:
- CaCO3 = CaO + CO2 ↑
За розчинністю у воді солі поділяють на добре розчинні, малорозчинні й практично нерозчинні. Добре розчинними є всі солі нітратної й ацетатної кислот, а також майже всі солі натрію, калію й амонію. До практично нерозчинних солей належать хлорид срібла AgCl, сульфат барію BaSO4, всі силікати (за винятком Na2SiO3 і K2SiO3) та ін.
Хімічні властивості солей визначаються їх взаємодією з кислотами, основами, металами та іншими солями.
1. Солі можуть взаємодіяти з кислотами лише в тому випадку, коли реагуюча кислота сильніша за ту, від якої походить дана сіль. Наприклад:
- FeS + 2HCl = FeCl2 + H2S ↑
- Na2SiO3 + Н2SO4 = Na2SO4 + H2SiO3 ↓
2. Солі можуть взаємодіяти з лугами, коли внаслідок реакції утворюється нерозчинна основа або нерозчинна сіль. Наприклад:
- FeCl3 + 3NaOH = 3NaCl + Fe(OH)3 ↓
- K2CO3 + Ba(OH)2 = 2KOH + BaCO3 ↓
3. Розчини солей можуть взаємодіяти з металами, коли даний метал в електрохімічному ряду напруги стоїть лівіше від металу солі. Наприклад:
- CuSO4 + Fe = FeSO4 + Cu
- HgCl2 + Cu = CuCl2 + Hg
4. Багато солей у розчинах можуть взаємодіяти одна з одною, коли одна з солей, що утворюється внаслідок реакції, є нерозчинною. Наприклад:
- Na2CO3 + CaCl2 = 2NaCl + CaCO3 ↓
- FeSO4 + BaCl2 = FeCl2 + BaSO4 ↓
Див. також
Джерела
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
Посилання
- Солі; Солі калійно-магнієві // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
