Галогеноалкани
Галоге́ноалка́ни, алкі́лгалогені́ди — органічні сполуки, що є результатом заміщення атомів Гідрогену у молекулах алканів (насичених вуглеводнів) на атоми галогенів — Флуор, Хлор, Бром, Йод[1].
Галогеноалкани широко використовуються як розчинники, холодоагенти (технічна назва фреони).
Номенклатура
Згідно номенклатури органічних сполук IUPAC галогеноалкани іменуються за допомогою додавання до назви основного карбонового ланцюга префіксів флуоро-, хлоро-, бромо- йодо- із зазначанням місця їхнього розташування. Для позначення наявності кількох однакових галогенних замісників префікси доповнюють грецькими числівниковими приставками ди-, три-, тетра- і т.д. У випадку наявність кількох різних замісників вони перераховуються у назві сполуки за абеткою (не беручи до уваги можливу наявність числівників).
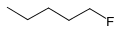 1-Флуоропентан
1-Флуоропентан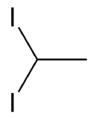 1,1-Дийодоетан
1,1-Дийодоетан 1,2-Дибромо-3-хлоропропан
1,2-Дибромо-3-хлоропропан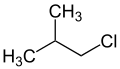 2-Метил-1-хлоропропан
2-Метил-1-хлоропропан
Альтернативна, радикально-замісникова номенклатура передбачає однослівний запис назви вуглеводневого радикала та галогеніду.
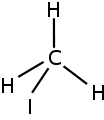 Метилйодид
Метилйодид Ізопропілбромід
Ізопропілбромід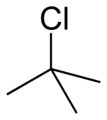 трет-Бутилхлорид
трет-Бутилхлорид
Фізичні властивості
Галогенопохідні метану (окрім йодометану) є безбарвними газами, нижчі представники галогеноалканів — безбарвні рідини із солодкуватим запахом.
Попри те, що галогеноалкани є полярними сполуками, вони нерозчинні у воді — ймовірно через те, що не утворюють водневих зв'язків. Вони розчинні у більшості органічних розчинників, розчиняють жири.
| Алкан | Галоген | ||||
|---|---|---|---|---|---|
| Флуор | Хлор | Бром | Йод | ||
| Етан | 0,5446[4] | 0,7182 | 0,8902 | 1,4604 | 1,9357 |
| н-Пропан | 0,493[5] | 0,7596[6] | 0,8899 | 1,3537 | 1,7489 |
| н-Бутан | 0,573[5] | 0,7789 | 0,8857 | 1,2758 | 1,6452 |
| н-Пентан | 0,6262 | 0,7907 | 0,8820 | 1,2182 | 1,5161 |
| н-Декан | 0,7266[7] | 0,8194 | 0,8696 | 1,0702 | 1,2546 |
При введенні у молекули алканів атомів Хлору, Брому і Йоду спостерігається зростання густини та температури кипіння, при чому ці значення збільшуються відповідно до атомного номера галогену — так, йодопохідні є значно важчими за інші аналоги. Так само ці значення збільшуються при введенні і кількох галогенів:
| Речовина | CH3Cl | CH2Cl2 | CHCl3 | CCl4 |
|---|---|---|---|---|
| Темп. кипіння, °C | -24 | 40 | 61 | 77 |
На противагу цьому у флуороалканів дані тенденції мають слабковиражений характер або ж відсутні зовсім: наприклад, заміщення атомів Хлору на Флуор у хлороалканах призводить до різкого падіння температури кипіння. Це явище пов'язують із їхніми надто слабкими міжмолекулярними взаємодіями.
| Речовина | CH3F | CH2F2 | CHF3 | CF4 |
|---|---|---|---|---|
| Темп. кипіння, °C | -78 | -52 | -83 | -128 |
Отримання
З алканів
Флуорування алканів фтором є надзвичано енергійним процесом і веде до повного заміщення атомів H, керування реакцією практично неможливе:
Можливе проведення флуорування при пропусканні вихідних речовин над кобальтовим або срібним каталізатором (який згодом регенерують фтором):
Хлорування і бромування алканів є доцільним лише для нижчих представників. Воно проходить за радикальним механізмом:
Отримання йодоалканів прямим йодуванням неможливе.
Зі спиртів
Спирти легко взаємодіють із галогеноводнями, утворюючи відповідний галогеноалкан і воду:
Даний тип реакцій має значне поширення як у лабораторній практиці, так і у промислових масштабах. Однак він застосовується здебільшого для йодо- і бромопохідних, оскільки реакція із хлороводнем проходить доволі важко, а із фтороводнем не відбувається взагалі.
Із ненасичених вуглеводів
Синтез галогенопохідних можливий шляхом приєднання галогеноводнів за ненасиченими зв'язками:
Реакційна здатність галогеноводнів знижується у ряді HI > HBr > HCl > HF.
Для отримання дизаміщених сполук проводиться реакція безпосереднього приєднання галогенів до алкенів або галогеноводнів до алкінів:
Тетрагалогеніди отримують з алкінів:
З карбонільних сполук
Гемінальні дигалогенопохідні отримують при обробці кетонів та альдегідів галогенідами фосфору або сірки (PBr3, SF4, SOCl2):
Реакції обміну
Оскільки флуоропохідні важко отримати безпосередньо, їх синтезують з інших галогеноалканів реакцією обміну:
Реакцією обміну можна отримувати йодопохідні:
Хімічні властивості
Хімічні властивості галогеноалканів більшою мірою визначаються полярністю зв'язку Карбон—галоген, яка знижується зі зниженням атомного номера галогену.
Для цього класу сполук характерними є реакції нуклеофільного заміщення. Вони протікають із легким заміщенням атома галогену, що дає змогу приєднувати до алкільної частини найрізноманітніші функціональні групи:
Галогеноалкани беруть участь у реакціях елімінування. Наприклад, при обробці трет-бутилброміду лугами відбувається дегідрогалогенування:
За реакцією Вюрца вони є основою для подовження карбонових ланцюгів:
Примітки
- Галоген Астат не приєднується до органічних сполук.
- При температурі 20 °C.
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- При температурі 89 °C.
- При температурі 25 °C і тиску менше 1 атм.
- При тиску менше 1 атм.
- При температурі 25 °C.
Джерела
- Bajzer, William X., Kim, Yung K. Fluorine Compounds, Organic // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 11. — P. 266. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Günter Siegemund et al. Fluorine Compounds, Organic // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Травень В. Ф. Органическая химия. Учебник для вузов. — М. : ИКЦ «Академкнига», 2004. — Т. 1. — С. 478. — ISBN 5-94628-068-6. (рос.)
- Чирва В. Я., Ярмолюк С. М., Толкачова Н. В., Земляков О. Є. Органічна хімія. — Львів : БаК, 2009. — 996 с. — ISBN 966-7065-87-4.
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.