Хлороцтова кислота
Хлороцтова кислота — це органічна сполука класу галогенкарбонових кислот з хімічною формулою .
| Хлороцтова кислота | |
|---|---|
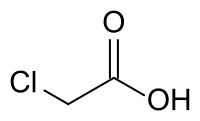 Структурна формула хлороцтової кислоти | |
.jpg.webp) Кристалізація хлороцтової кислоти | |
| Назва за IUPAC | 2-хлоретанова кислота |
| Інші назви | Монохлороцтова кислота, хлорооцтова кислота |
| Ідентифікатори | |
| Номер CAS | 79-11-8 |
| Номер EINECS | 201-178-4 |
| Номер EC | 201-178-4 |
| KEGG | D07677 і C06755 |
| ChEBI | 27869 |
| RTECS | AF8575000 |
| SMILES |
C(C(=O)O)Cl |
| InChI |
1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4,5) |
| Номер Бельштейна | 605438 |
| Властивості | |
| Зовнішній вигляд | безбарвні гігроскопічні кристали |
| Густина | 1,58 г/см3 (20°С) |
| Тпл | 63°C (α-форма), 56,2°C (β-форма), 52,5 (γ-форма) |
| Ткип | 189°C |
| Розчинність (вода) | 421 г/100г (20°С), 604-614 г/100г (30°С), 1329 г/100г (45°С) |
| Діелектрична проникність (ε) | 12,3 (20°С) |
| Структура | |
| Кристалічна структура | моноклінна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-504,6 кДж/моль |
| Ст. ентальпія згоряння ΔcH |
-715,9 кДж/моль |
| Ст. ентропія S |
325,9 (газ) |
| Теплоємність, c |
78,8(газ) |
| Небезпеки | |
| ЛД50 | 55мг/кг (орально, щури), 76мг/кг (перорально, щури), 180мг/кг (інгаляційно, щури) |
| ГГС піктограми | 
|
| ГГС формулювання небезпек | H301, H311, H314, H331, H400 |
| ГГС запобіжних заходів | P260, P261, P264, P270, P271, P273, P280, P301+P310
, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P311, P312 , P321, P322, P330, P361, P363, P391, P403+P233, P405 , P501 |
| NFPA 704 |
 1
4
0
|
| Температура спалаху | 126°C |
| Температура самозаймання | 470°C |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Будова
Хлороцтова кислота може бути у 4 кристалічних формах: α-, β-, γ- та δ-формі. Найстабільніною є α-форма. В α-формі кислота має моноклінну сингонію. Параметри кристалічної гратки у α-формі: а = 538 пм, b = 1927 пм, с = 801 пм, β = 109,5°[1].
Хімічні властивості
Проявляє хімічні властивості, характерні для карбонових кислот: утворює солі, естери:[2]
Реакції нуклеофільного заміщення
Як і інші галогенкарбонові кислоти, вступає у реакції нуклеофільного заміщення.[2][3]
При нагріванні водного розчину чи розчину солі утвооюється гідроксиетанова кислота:[3]
При взаємодії з аміаком зазвичай утворюється аміноетанова кислота, але за певних умов усі три атоми гідрогену аміаку можуть прореагувати, утоврюючи нітрилотриоцтову кислоту:[3]
Реакція з ціанідом калію дає ціанооцтову кислоту:[3]
Реакція з йодидом натрію є важливим методом одержання йодетанової кислоти:[2]
Утворення хлорангідриду
При взаємодії з трихлоридом фосфору, тіонілхлоридом чи фосгеном утворює хлорангідрид:[3]
Отримання
Отримують α-галогенуванням оцтової кислоти у присутності червоного фосфору чи трихлориду фосфору. Роль каталізатора полягає у тому, що він перетворює оцтову кислоту на її хлорангідрид, який хлорується за атомом карбону швидше, ніж оцтова кислота:[2]
Іншим способом є гідратація трихлоретилену з подальшим гідролізом у присутності сульфатної кислоти:[2]
Токсичність
Хлороцтова кислота дуже токсична. Подразнює дихальні шляхи, викликає опіки. Опіки шкіри призводять до значних втрат рідини. Якщо понад 3% шкіри піддається впливу кислоти, це може бути смертельно[4].
Примітки
- XuMuK.ru - ХЛОРУКСУСНЫЕ КИСЛОТЫ - Химическая энциклопедия. xumuk.ru (російська).
- Ластухін, Воронов (2006). Органічна хімія. с. 454. ISBN 966-7022-19-6.
- Koenig, Günter; Lohmar, Elmar; Rupprich, Norbert; Lison, Martin; Gnass, Alexander (15 жовтня 2012). У Wiley-VCH Verlag GmbH & Co. KGaA. Chloroacetic Acids. Ullmann's Encyclopedia of Industrial Chemistry (англ.). Weinheim, Germany: Wiley-VCH Verlag GmbH & Co. KGaA. с. a06_537.pub3. ISBN 978-3-527-30673-2. doi:10.1002/14356007.a06_537.pub3.
- Chloroacetic acid|ClCH2COOH - PubChem. pubchem.ncbi.nlm.nih.gov (англійська). Процитовано 16 вересня 2004.

