Гідрид алюмінію
Гідри́д алюмі́нію — полімерна неорганічна сполука складу (AlH3)n, за звичайних умов являє собою білу або прозору тверду речовину. Сполука використовується як складова частина ракетного палива, ефективного відновника в лабораторному синтезі, зокрема для добування інших гідридів.
| Гідрид алюмінію | |
|---|---|
 α-структура AlH3 | |
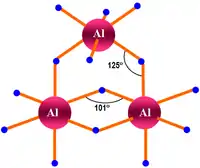 γ-структура AlH3 | |
| Систематична назва | Алюміній гідрид |
| Інші назви | алан |
| Ідентифікатори | |
| Номер CAS | 7784-21-6 |
| Номер EINECS | 232-053-2 |
| ChEBI | 30136 |
| SMILES |
[AlH3][1] |
| InChI |
InChI=1S/Al.3H |
| Номер Гмеліна | 245 |
| Властивості | |
| Молекулярна формула | (AlH3)n |
| Зовнішній вигляд | біла або прозора тверда речовина |
| Тпл | 105°C[2] |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Структура
Гідрид алюмінію є полімером, він може існувати в вигляді сімох можливих модифікацій: α-(AlH3)n, α1-(AlH3)n, β-(AlH3)n, δ-(AlH3)n, ε-(AlH3)n, γ-(AlH3)n та ζ-(AlH3)n. Найбільш стабільною є альфа-модифікація, в яку після нагрівання переходять модифікації бета та гамма.
Отримання
Вперше AlH3 було отримано за реакцією між галогенідами алюмінію та алюмогідридами в ефірному розчині:
Безпосереднє виділення полімеру з ефіру неможливе через утворення важкорозчинного комплексу (AlH3)n [O(C2H5)2]m.
Синтез гідриду алюмінію з галогенідів не виключає можливість наявності домішок у продукті. Для отримання високочистого AlH3 застосовують метод електролізу розчину алюмогідриду натрію у тетрагідрофурані (THF). Як анод і катод використовують алюміній амальгамоване залізо відповідно. Алюмінієвий анод може бути нерозчинним (реакція 1) і розчинним (реакція 2); іони натрію, утворюючи амальгаму, виключають перебіг побічних реакцій:
Хімічні властивості
Гідрид алюмінію є малостійкою сполукою, розкладається при 105 °C з виділенням водню:
Він активно взаємодіє з водою:
Широкого застосування AlH3 набув завдяки своїм сильним відновним властивостям, його використовують переважно в ході органічних синтезів: для відновлення карбонільних, карбоксильних груп тощо.
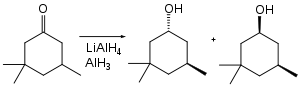
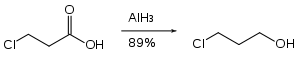
Алюміній гідрид бере участь в реакціях утворення інших гідридів:
Застосування
Гідрид алюмінію використовується у лабораторіях як сильний відновник. Він є складовою частиною ракетного палива й деяких видів вибухівки. Можливим є використання гідриду для акумулювання водню, однак через низьку стійкість сполуки розробки щодо цього не ведуться.
Див. також
Примітки
- alumane
- За тиску 101,3 кПа
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / В. И. Спицын. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)