Діагностика коронавірусної хвороби 2019
Діагностика респіраторного захворювання коронавірусна хвороба 2019 (COVID-19) ускладнена відсутністю характерних симптомів хвороби. Виявлення вірусу SARS-CoV-2, який викликає цю хворобу, можливе двома основними методами: розпізнавання молекул нуклеїнових кислот вірусу та імунохімічний пошук антитіл. До молекулярно-генетичних методів належать полімеразна ланцюгова реакція (ПЛР) та інші методи виявлення генетичного матеріалу вірусу. Наприклад, Центр контролю захворювань (CDC) розробив полімеразну ланцюгову реакцію зі зворотною транскрипцією в реальному часі для діагностичних цілей. При пошуку антитіл використовується імуноферментний аналіз — набір для виявлення присутності антитіл, вироблених імунною системою зараженої людини проти вірусу. Китайський CDC проводить два теста ELISA проти двох різних білків, які продукуються вірусом. Якщо якийсь з тестів є позитивним, для підтвердження позитивного результату проводиться тест на мікронейтралізацію. Аналіз мікронейтралізації є високоспецифічним, але значно більш трудомістким і тривалим. Оскільки антитіла продовжують циркулювати навіть після того, як інфекція усунена, серологічні тести продовжують бути позитивними для людей, які раніше піддавалися впливу і розвинули імунну відповідь, що означає, що позитивний тест може не вказувати на активну інфекцію. Таким чином, CDC використовує імунохімічну діагностику тільки для спостереження і в дослідницьких цілях, у той час як молекулярно-генетичні методи використовуються для діагностики інфікованих людей.

Методи досліджень
| Країна | Установа | Gene targets |
|---|---|---|
| Китай | China CDC | ORF1ab and Nucleoprotein (N) |
| Німеччина | Charité | RdRP, E, N |
| Гонконг | HKU | ORF1b-nsp14, N |
| Японія | National Institute of Infectious Diseases, Department of Virology III | Pancorona and multiple targets, Spike protein (Peplomer) |
| Таїланд | National Institute of Health | N |
| США | US CDC | Three targets in N gene |
| Франція | Pasteur Institute | Two targets in RdRP |
ПЛР
Один з ранніх тестів ПЛР був розроблений в клініці «Шаріте» в Берліні в січні 2020 року з використанням полімеразної ланцюгової реакції зі зворотною транскрипцією в реальному часі (rRT-PCR) і ліг в основу 250 000 наборів для поширення Всесвітньою організацією охорони здоров'я (ВООЗ).[2]
Південнокорейська компанія «Kogenebiotech» розробила клінічний комплект для виявлення SARS-CoV-2 на основі ПЛР («PowerChek Coronavirus») 28 січня 2020 року.[3][4] Він шукає ген E, загальний для всіх бета-коронавірусів, і ген RdRp, специфічний для SARS-CoV-2.[5] Інші компанії в країні, такі як «Solgent» і «Seegene», теж розробили версії наборів для визначення клінічного рівня, названі «DiaPlexQ» і «Allplex 2019-nCoV Assay», відповідно, в лютому 2020 року.
Китайська «BGI Group» була однією з перших компаній, що отримали дозвіл від Національного управління медичної продукції Китаю на екстрене використання комплекту виявлення SARS-CoV-2 на основі ПЛР.[6]
У Сполучених Штатах Центри з контролю і профілактики захворювань (CDC) поширюють діагностичну панель RT-PCR в реальному часі «CDC 2019-Novel Coronavirus (2019-nCoV)» серед лабораторій громадського здоров'я через Міжнародний ресурс реагентів.[7] Один з трьох генетичних тестів в більш старих версіях тестових наборів показав непереконливі результати і вузьке місце тестування в CDC в Атланті; випробування з використанням двох компонентів були визнані надійними 28 лютого 2020 року, що дозволило державним і місцевим лабораторіям швидко завершити випробування.[8] Тест було схвалено Управлінням по санітарному нагляду за якістю харчових продуктів і медикаментів на підставі дозволу на екстрене використання.
Комерційні лабораторії США почали випробування на початку березня 2020 року. З 5 березня 2020 року «LabCorp» оголосила про доступність тестування COVID-19 на основі ЗТ-ПЛР по всій країні.[9] Quest Diagnostics також зробив загальнонаціональне тестування COVID-19 доступним з 9 березня 2020 року.[10] Збір і обробка зразків повинні виконуватися згідно з вимогами CDC.
Повідомлялося, що 12 березня 2020 року в клініці Майо був розроблений тест для виявлення інфекції COVID-19.[11]
13 березня 2020 року «Roche Diagnostics» отримала схвалення FDA на випуск тесту, який може бути проведений протягом 3,5 годин, що дозволило одному приладу виконати приблизно 4128 тестів протягом 24 годин.[12]
Ціна на ПЛР-тест для українців до листопада 2020 року була 998 гривень, потім піднялася до 1100 грн[13].
.jpg.webp) Забір мазку із носа на тест на COVID-19
Забір мазку із носа на тест на COVID-19.jpg.webp) Забір мазку із рота на тест на COVID-19
Забір мазку із рота на тест на COVID-19 ПЛР-лабораторія
ПЛР-лабораторія
Експрес-тести ІФА
Ще 26 лютого 2020 року не було ані тестів на антитіла, ані тестів в місцях надання медичної допомоги, хоча зусилля по їх розробці тривають.[14]
28 лютого 2020 року південнокорейська компанія «PCL» подала запит в Міністерство харчової і лікарської безпеки Південної Кореї на їх набір для виявлення на основі антитіл «COVID-19 Ag GICA Rapid». На відміну від набору для визначення на основі ЗТ-ПЛР, «PCL» стверджувала, що їх набір на основі антитіл може поставити діагноз протягом 10 хвилин.
8 березня 2020 року тайванська Academia Sinica оголосила, що моноклональне антитіло, що специфічно зв'язує білок нуклеокапсида (N-білок) нового коронавірусу, було успішно створено та протестовано за 19 днів. Якщо може бути розроблений набір для швидкого імунологічного тестування, він зможе виявити захворювання протягом 15-20 хвилин, аналогічно швидкому тесту на грип.[15]
Компанія «BioMedomics» з Північної Кароліни, США, стверджувала, що розробила експрес-тест на антитіла, який дасть результати через 15 хвилин.[16] Він виявляє антитіла як IgM, так і IgG, використовуючи кров, узяту з вени або пальця.[17] В Китаї було використано півмільйона тестів, і тепер[коли?] BioMedomics очікує схвалення FDA.[18]
Паперові смужки на основі CRISPR
Досліджується метод, заснований на активності розщеплення колатеральної одноланцюгової ДНК (ssDNA) за допомогою CRISPR[19][20] Коротко, зразок РНК ретранскрібується в кДНК і ампліфікується з використанням ампліфікації рекомбіназної полімерази в поєднанні з ферментом зворотної транскриптази. Це посилення є ізотермічним і, отже, вимагає набагато більш простого обладнання, ніж ПЛР. Якщо у зразку присутня цільова РНК з SARS-CoV-2, відповідна кДНК зв'язується з Cas12a і запускає колатеральне розщеплення міченого флуоресцеїном одноланцюгового зонда ДНК. Це розщеплення випускає флуоресцентний сигнал, який може бути інтерпретований на пристрої для планшетів або, альтернативно, виявлений на паперовій смузі (за допомогою бічного потоку) портативним способом. Цей метод був протестований на змодельованих клінічних зразках (тобто додавання синтетичних фрагментів РНК SARS-CoV-2 до зразків слини від здорового донора), але не був протестований на зразках пацієнтів.
Немолекулярні методи
Комп'ютерна томографія грудної клітки
КТ грудної клітки іноді може допомогти визначити і охарактеризувати патологію легенів і дати неспецифічні результати при інфекції COVID-19. Систематичний огляд результатів комп'ютерної томографії грудної клітки у 919 пацієнтів описав типове ранній прояв COVID-19 як «двостороннє мультилобарне помутніння матового скла (GGO) з периферичним або заднім розподілом».[21] Одне дослідження показало, що чутливість КТ до інфекції COVID-19 склала 98 % порівняно з чутливістю ОТ-ПЛР (RT-PCR) на 71 %; проте це було зроблено в китайській провінції Ухань і не підлягає узагальненню.[22] Найбільш поширеними результатами комп'ютерної томографії були двостороннє загасання матового скла (плямисте або розсіяне) з субплевральним домінуванням, божевільним укладанням та консолідацією на більш пізніх стадіях.[23] Ці дані є неспецифічними і виявляються також при інших типах пневмонії. Невелике дослідження показало, що китайські рентгенологи продемонстрували чутливість 72-94 % і 24-94 % в диференціюванні COVID-19 від інших типів вірусної пневмонії з використанням комп'ютерної томографії.[24] Жодне дослідження ще не підтвердило точність і дискримінаційну цінність комп'ютерних томографій, щоб відрізнити COVID від інших вірусних пневмоній. Тому CDC не рекомендує CT для первинного скринінгу, як підкреслювалося в дзвінку COCA у четвер, 5 березня. Люди з підозрою на COVID повинні проходити RT-PCR, яка є найбільш специфічним тестом.
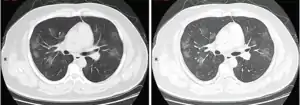 Типові результати комп'ютерної томографії
Типові результати комп'ютерної томографії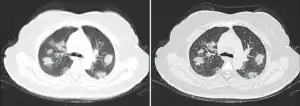 Комп'ютерна томографія стадії швидкого прогресування
Комп'ютерна томографія стадії швидкого прогресування
Збір зразків
Використовуючи зворотну транскрипцію та полімеразну ланцюгову реакцію в реальному часі (ЗТ-ПЛР, rRT-PCR)[25] тест може бути проведений на зразках дихальних шляхів, отриманих різними методами, включаючи мазок з носоглотки або зразок мокротиння.[26] Результати отримують від декількох годин до 2 днів.[27]
Гонконг розробив схему, в якій підозрювані пацієнти можуть залишатися вдома: «відділення невідкладної допомоги передасть пацієнту пробірку зі зразком», вони плюють в неї, відправляють назад, а потім через деякий час отримують результат тесту.[28]
Британська NHS оголосила, що почне перевіряти підозрілі випадки в будинку, що усуває ризик зараження пацієнта іншими, якщо вони потрапляють в лікарню або дезінфікують швидку допомогу, якщо така використовується.[29]
В ході наскрізного тестування на COVID-19 для підозрілих випадків медичний працівник бере зразок з дотриманням відповідних заходів безпеки.[30][31] Прохідні центри допомогли Південній Кореї провести одне із самих швидких і масштабних випробувань в будь-якій країні.[32]
.jpg.webp)
.jpg.webp) Кров із піпетки переноситься на швидкий тест COVID-19.
Кров із піпетки переноситься на швидкий тест COVID-19.
Виробництво та обсяг тестування

Синій: лабораторія CDC
Помаранчевий: Лабораторія громадської охорони здоров'я
Сірий: неповні дані внаслідок затримки звітності
Китай[33] і Сполучені Штати[34] мали проблеми з надійністю тест-наборів до початку спалаху, і ці країни і Австралія[35] не змогли надати достатньо наборів для задоволення попиту і рекомендацій для тестування експертами охорони здоров'я. На відміну від цього, експерти кажуть, що широка доступність тестування в Південній Кореї допомогла знизити поширення нового коронавірусу. Протягом кількох років уряд Південної Кореї створював можливості для проведення випробувань, в основному в лабораторіях приватного сектора.[36] 16 березня Всесвітня організація охорони здоров'я закликала активізувати програми тестування як кращий спосіб уповільнити розвиток пандемії Covid-19.[37][38]
Процедура діагностики на COVID-19
Показання
Обстеження на COVID-19 призначалося медичними працівниками у разі:
- прибуття з епідеміологічно неблагополучних з COVID-19 країн і регіонів за 14 днів до появи симптомів;
- наявності тісних контактів за останні 14 днів з особами, які перебувають під наглядом з COVID-19, які в подальшому захворіли;
- наявності тісних контактів за останні 14 днів з особами, у яких лабораторно підтверджено діагноз COVID-19;
Див. також
Примітки
- Coronavirus disease (COVID-19) technical guidance: Laboratory testing for 2019-nCoV in humans. www.who.int. Процитовано 6 березня 2020.
- Sheridan, Cormac. Coronavirus and the race to distribute reliable diagnostics // Nature Biotechnology : journal. — Nature Publishing Group, 2020. — 2.
- 접속하신 사이트는허용 접속량을 초과하였습니다. (Homepage). Kogene.co.kr. Процитовано 16 березня 2020.
- Jeong, Sei-im (28 лютого 2020). Korea approves 2 more COVID-19 detection kits for urgent use - Korea Biomedical Review. www.koreabiomed.com (кор.). Процитовано 12 березня 2020.
- ABOUT US | NEWS.
- BGI Sequencer, Coronavirus Molecular Assays Granted Emergency Use Approval in China. GenomeWeb (англ.). Процитовано 9 березня 2020.
- International Reagent Resource > Home. www.internationalreagentresource.org.
- Transcript for the CDC Telebriefing Update on COVID-19, Feb 282020
- LabCorp Launches Test for Coronavirus Disease 2019 (COVID-19).
- Covid19 : COVID-19. www.questdiagnostics.com.
- Plumbo, Ginger. Mayo Clinic develops test to detect COVID-19 infection. Mayo Clinic (англ.). Процитовано 13 березня 2020.
- www.ETHealthworld.com. US regulators approve Roche's new and faster COVID-19 test - ET HealthWorld. ETHealthworld.com (англ.). Процитовано 14 березня 2020.
- В дитячій поліклініці підвищили ціну на ПЛР-тест - izhytomyryanyn.com. izhytomyryanyn.com (укр.). Процитовано 28 листопада 2020.
- Pang, Junxiong. // Journal of Clinical Medicine : journal. — 2020. — Vol. 9, no. 3 (2). — DOI:. — PMID:.
- 中央研究院網站. www.sinica.edu.tw (Sinca). Процитовано 12 березня 2020.
- https://www.biomedomics.com/products/infectious-disease/covid-19-rt/
- https://www.ncbi.nlm.nih.gov/pubmed/32104917
- https://www.ncbiotech.org/news/biomedomics-seeks-fda-ok-covid-19-rapid-diagnostic
- Chen, Janice S. // Science : journal. — 2018. — Vol. 360, no. 6387 (4). — P. 436—439. — ISSN 0036-8075. — Bibcode:. — DOI:. — PMID:.
- Lucia, Curti. // bioRxiv : journal. — 2020. — 3. — P. 2020.02.29.971127. — DOI:.
- Salehi, Sana. // American Journal of Roentgenology : journal. — 2020. — 3. — P. 1—7. — ISSN 0361-803X. — DOI:.
- Ai, Tao. // Radiology : journal. — Radiological Society of North America, 2020. — 2. — DOI:.
- Lee, Elaine Y. P. // The Lancet Infectious Diseases : journal. — Elsevier, 2020. — 2. — ISSN 1473-3099. — DOI:. Процитовано 2020-03-13.
- Bai, Harrison X. // Radiology : journal. — 2020. — 3. — P. 200823. — ISSN 0033-8419. — DOI:. Процитовано 2020-03-17.
- 2019 Novel Coronavirus (2019-nCoV) Situation Summary. Centers for Disease Control and Prevention. 30 січня 2020. Архів оригіналу за 26 січня 2020. Процитовано 30 січня 2020.
- Real-Time RT-PCR Panel for Detection 2019-nCoV. Centers for Disease Control and Prevention. 29 січня 2020. Архів оригіналу за 30 січня 2020. Процитовано 1 лютого 2020.
- Curetis Group Company Ares Genetics and BGI Group Collaborate to Offer Next-Generation Sequencing and PCR-based Coronavirus (2019-nCoV) Testing in Europe. GlobeNewswire News Room. 30 січня 2020. Архів оригіналу за 31 січня 2020. Процитовано 1 лютого 2020.
- In Age of COVID-19, Hong Kong Innovates To Test And Quarantine Thousands. NPR.org (англ.).
- NHS pilots home testing for coronavirus. MobiHealthNews (англ.). 24 лютого 2020.
- jkiger@postbulletin.com, Jeff Kiger. Mayo Clinic starts drive-thru testing for COVID-19. PostBulletin.com (англ.). Процитовано 13 березня 2020.
- Hawkins, Andrew J. (11 березня 2020). Some states are offering drive-thru coronavirus testing. The Verge (англ.). Процитовано 13 березня 2020.
- South Korea's Drive-Through Testing For Coronavirus Is Fast — And Free. npr (англ.). 11 березня 2020. Процитовано 16 березня 2020.
- Heartbreak in the Streets of Wuhan
- State figures on testing raise questions about efforts to contain outbreak - The Boston Globe. BostonGlobe.com.
- Davey, Melissa (14 березня 2020). Australian stocks of coronavirus testing kits 'rapidly deteriorating', says chief medical officer.
- Experts Credit South Korea's Extensive Testing For Curbing Coronavirus Spread. NPR.org.
- 'Test, Test, Test': WHO Chief's Coronavirus Message to World. The New York Times. 16 березня 2020. Процитовано 16 березня 2020.
- Reuters, Source (16 березня 2020). 'Test, test, test': WHO calls for more coronavirus testing – video. The Guardian. Процитовано 16 березня 2020.