Діазометан
Діазометан — це найпростіша діазосполука. Хімічні формула — .
| Діазометан | |
|---|---|
 | |
| Назва за IUPAC | Діазометан |
| Систематична назва | Діазометан |
| Інші назви | Азиметан, Діазирин |
| Ідентифікатори | |
| Номер CAS | 334-88-3 |
| Номер EINECS | 206-382-7 |
| Номер EC | 006-068-00-8 |
| KEGG | C19387 |
| ChEBI | 73716 |
| RTECS | PA7000000 |
| SMILES |
C=[N+]=[N-] |
| InChI |
InChI=1S/CH2N2/c1-3-2/h1H2 |
| Номер Бельштейна | 102415 |
| Властивості | |
| Молекулярна формула | CH2N2 |
| Молярна маса | 42.041 г/моль |
| Молекулярна маса | 42.04 а. о. м. |
| Зовнішній вигляд | Жовтий газ |
| Тпл | -145 °C |
| Ткип | -23 °C |
| Термохімія | |
| Ст. ентропія S |
242.9 Дж/(моль•К) |
| Теплоємність, c |
52.5 Дж/(моль•К) |
| Небезпеки | |
| ГГС піктограми |  |
| ГГС формулювання небезпек | H350 |
| ГГС запобіжних заходів | P201, P202, P281, P308+P313, P405, P501 |
| Класифікація ЄС | Токсичний T |
| R-фрази | R45 |
| S-фрази | S45, S53 |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Будова
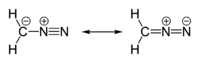
Нітроген у молекулі діазометану заряджений позитивно. Її будову можна зобразити як або як . Насправді негативний заряд розподілений між CH2 та N, при чому на групі CH2 негативного заряду трохи більше. Тому кратність зв'язку C-N трохи менша за 3/2, а зв'язку N-N — трохи більша за 5/2.
Молекула має лінійну будову. Довжина зв'язку CN — 134 пм, зв'язку N-N — 113 пм.
Фізичні властивості
За звичайних умов діазометан є жовтим газом. Температура плавлення — -145°С, температура кипіння — -23°С. Ентальпія утворення — 192.5 кДж/моль, ентропія — 242.9 Дж/(моль*К).
Хімічні властивості
Діазометан хімічно дуже активний. Проявляє основні та нуклеофільні властивості, є метилюючим агентом. Може реагувати з речовинами, в яких є рухливий атом гідрогену — водою, кислотами. Для взаємодії зі спиртами потрібен каталізатор:
Реакція йде наступним чином: спочатку заряд CH2 дорівнює -1/2, а заряд N2 — +1/2. Протон приєднується до CH2, утворюючи катіон . Потім від нього відщеплюється молекула азоту, залишаючи CH3+. В кінці до нього приєднується X-.
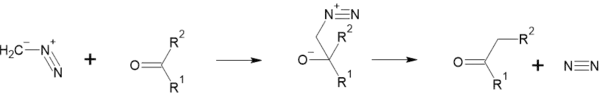
Як нуклеофіл, може приєднуватися до альдегідів та кетонів. При взаємодії з формальдегідом утворюється ацетальдегід. При взаємодії з іншими альдегідами утворюються кетони:
Коли він взаємодіє з кетонами, один з радикалів переходить до CH2:
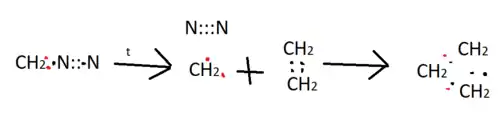
При нагріванні розкладається на азот та карбен, який може легко приєднуватись до подвійних зв'язків, утворюючи тричленні цикли:
Взаємодія з бензеном призводить до розширення циклу й утворення циклогептатриєну. При взаємодії з циклічними кетонами також відбувається розширення циклу[1]:
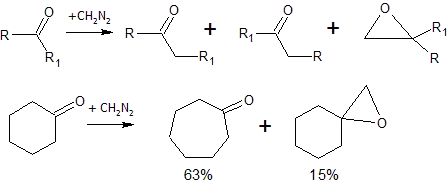
Отримання
Вперше діазометан був відкритий Г. Пехманом у 1894 році. Він отримав його при взаємодії гідразину та трихлорметану у лужному середовищі:
Найкраще отримувати діазометан зі сполук, що містять замісники з - I-ефектом у α-положені до аміногрупи, наприклад, алкілсечовини, алкілуретанів. З них отримують їх N-нітрозопохідні. Метилсечовину також отримують з метиламіну та Cl-CO-NH2:
(Реакція йде у лужному середовищі через виділення кислоти)
Замість N-метилсечовини можна також використати метилуретан CH3-NH-CO-OC2H5.
Посилання
Література
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.
- О. Я. Нейланд. Органическая химия. — М.: Высшая школа, 1990. — 751 с. — 35 000 экз. — ISBN 5-06-001471-1.
- Потапов, Виктор Михайлович; Татаринчик, Софья Наумовна (1980). Органическая химия (російська). Москва: Химия.