Етаналь
Етана́ль (о́цтовий альдегі́д) — другий член гомологічного ряду аліфатичних альдегідів. Безбарвна рідина з різким задушливим запахом, при розбавленні водою набуває фруктового запаху. Проміжний продукт обміну речовин в живому організмі. Застосовується для виробництва ацетатів целюлози, оцтової кислоти, бутанолу та ін. Канцерогенний для людини згідно з даними Міжнародного агентства з дослідження раку [2][3].
| Етаналь[1] | |
|---|---|
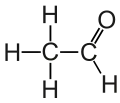 Структурна формула оцтового альдегіду |
 Функціональні групи атомів, що входять до молекули оцтового альдегіду |
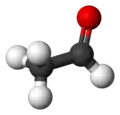 3D-модель молекули оцтового альдегіду |
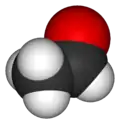 Молекула оцтового альдегіду |
| Назва за IUPAC | Етаналь |
| Інші назви | Оцтовий альдегід, ацетальдегід, метилформальдегід |
| Ідентифікатори | |
| Номер CAS | 75-07-0 |
| PubChem | 177 |
| Номер EINECS | 200-836-8 |
| Номер EC | 200-836-8 |
| KEGG | C00084 |
| Назва MeSH | D02.047.064 |
| ChEBI | CHEBI:15343 |
| RTECS | AB1925000 |
| SMILES |
O=CC |
| InChI |
1S/C2H4O/c1-2-3/h2H,1H3 |
| Номер Бельштейна | 505984 |
| Номер Гмеліна | 779 |
| Властивості | |
| Молекулярна формула | C2H4O |
| Молярна маса | 44,05 г/моль |
| Молекулярна маса | 44 а. о. м. |
| Зовнішній вигляд | Безбарвна рідина |
| Запах | Різкий задушливий |
| Густина | 0,784 г/см³ |
| Тпл | −123,37 °C |
| Ткип | 20,16 °C |
| Розчинність (вода) | Розчинний |
| Тиск насиченої пари | 279,4 кПа (50 °C) |
| Кислотність (pKa) | 13,57 |
| Показник заломлення (nD) | 1,33113 |
| В'язкість | 0,02456 мПа • с (15 °C) |
| Дипольний момент | 2,7 |
| Структура | |
| Кристалічна структура | тригональна біпіраміда |
| Дипольний момент | 0 |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-166 кДж/моль |
| Ст. ентальпія згоряння ΔcH |
-1186,79 кдж/моль (рідина) |
| Ст. ентропія S |
250 Дж/(моль•К) |
| Теплоємність, c |
2,18 Дж/(г•К) (0 °C) |
| Небезпеки | |
| ГДК (Україна) | 5 мг/м3 |
| ГГС запобіжних заходів | 210, 261, 281, 305+351+338 |
| Класифікація ЄС | Дуже горючий (F+) Шкідливий (Xn) |
| R/S фрази | R12 R36/37 R40 S2 S16 S33 S36/37 |
| NFPA 704 |
 4
2
2
|
| Температура спалаху | −39 °C |
| Температура самозаймання | 185 °C |
| Вибухові границі | 4,0–6,0 % |
| Пов'язані речовини | |
| Пов'язані речовини | Формальдегід, Оксиран |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Будова
У етаналю, як і у будь-якого іншого альдегіду, три атоми з'єднані з центральним тригональним атомом (а саме: атом Оксигену, атом Гідрогену і атом Карбону). Всі вони лежать в одній площині з цим тригональним атомом. Всі кути зв'язків тригонального атома з цими атомами близькі до 120 °[4].
У карбонільній групі є дуже велика різниця в електронегативності між атомами Карбону і Оксигену. Це відображається у великому дипольному моменті оцтового альдегіду. Електрони зв'язку C=O розподілені нерівномірно, тому молекула етаналю сильно полярна. Для якісного опису природи зв'язку в карбонільній групі зазвичай використовують уявлення про подвійний зв'язок, що містить σ- і π-компоненти з двома парами незв'язаних (n) електронів у атома Оксигену. Прийнято, що тригональний атом Карбону знаходиться в стані sp2-гібридизації і утворює σ-зв'язок з Гідрогеном та іншим атомом Карбону.
Фізичні властивості
Етаналь, як і всі альдегіди, не здатен утворювати водневих зв'язків, тому його температура кипіння становить лише 20,16 °C. За звичайних умов — це безбарвна рідина з різким задушливим запахом, при розбавленні водою набуває фруктового запаху. Добре розчиняється у воді, спирті, ефірі.
Отримання
Процес Вакера
Головним промисловим способом отримання оцтового альдегіду є процес Вакера. Він полягає в окисненні етилену, який отримують при крекінгу вуглеводнів. Цей спосіб має набагато більше значення, ніж окиснення, каталітична дегідрогенізація етанолу чи гідратація ацетилену. У процесі Вакера етилен окиснюють у водному розчині, що хлорид міді(II) і хлорид паладію(II). У одностадійному варіанті каталізатор регенерують киснем в умовах безперервного синтезу, у двостадійному варіанті каталізатор регенерують повітрям в окремому реакторі. Реакція каталізується паладієм.
З дигалогенопохідних
В результаті гідролізу дигалогенопохідних з двома атомами галогену при одному атомі Карбону утворюються двохатомні спирти, що містять дві гідроксильні групи також при одному атомі Карбону. Такі діоли вкрай нестійкі і легко відщеплюють молекулу води. Таким чином з 1,1-дихлоретану можна отримати етаналь.
З етанолу
При окисненні етанолу киснем повітря при температурі 300—500 °C за наявності каталізаторів, а також такими окисниками, як хромова суміш, оксид хрому(VI), манган(IV) оксиду та ін., утворюється оцтовий альдегід.
Даний процес доволі важко зупинити на стадії утворення альдегіду і він може тривати до одержання оцтової кислоти.
З етанолу етаналь можна одержати і дегідрогенізацією. Для цього випари спирту необхідно пропустити над каталізаторами (цинк, мідь) при високих температурах.
З ацетилену
Етаналь можна одержати гідратацією ацетилену. Як каталізатори в процесі застосовуються солі ртуті.
Хімічні властивості
Взаємодія з ціанідами металів
При взаємодії етаналю з солями ціанідної кислоти утворюються гідроксинітрили. Сама синильна кислота малодисоційована. Тому реакцію проводять у лужному середовищі, де утворюється ціанід-іон, який є активною нуклеофільною частинкою.
Реакція є досить важливою в органічній хімії. По-перше, вона дозволяє подовжити карбоновий ланцюг вихідної сполуки на один атом Карбону. По-друге, продукт реакції — 2-гідроксипропанонітрил служить вихідним продуктом для синтезу відповідної гідроксикарбонової кислоти.
Взаємодія з водою
Оцтовий альдегід вступає у оборотну реакцію гідратації, утворюючи відповідний гідрат.
Етаналь у водному розчині гідратований на 51 %[5].
Взаємодія зі спиртами
Спирти, як і вода, оборотно приєднуються до етаналю з утворенням півацеталей. В спиртових розчинах півацеталі перебувають у рівновазі з оцтовим альдегідом. Так, в етанольному розчині етаналю міститься близько 30 % півацеталю (1-етоксиетанолу) (в розрахунку на альдегід).
При взаємодій з другою молекулою спирту в умовах кислотного каталізу півацеталі перетворюються в ацеталі.
Взаємодія з амінами
На першій стадії реакції відбувається нуклеофільне приєднання аміну за подвійним зв'язком C=O карбонільної групи. Первинним продуктом приєднання є біполярний іон, який стабілізується в результаті внутрішньомолекулярного перенесення протона від атома Нітрогену до атома Оксигену, перетворюючись на аміноспирт. Однак реакція не зупиняється на цій стадії, адже сполуки, що містять дві електроноакцепторні групи при одному атомі Карбону, нестійкі і прагнуть до стабілізації шляхом відщеплення однієї з груп у вигляді нейтральної термодинамічно стабільної молекули. В даному випадку відбувається відщеплення молекули води від молекули аміноспирту і утворюється імін (основа Шиффа).
Подібно до взаємодії з первинними амінами проходять реакції етаналю з такими похідними амоніаку, як гідроксиламін NH2OH, гідразин H2N-NH2, фенілгідразин C6H5NHNH2 та ін. Утворені похідні оцтового альдегіду — оксими, гідразони, фенілгідразони — зазвичай є стійкими кристалічними речовинами з чіткими температурами плавлення.
Відновлення
Етаналь відновлюється до етанолу. Одним із ефективних відновників є алюмогідрид літію LiAlH4. Він відіграє роль постачальника гідрид-іонів H-, які є нуклеофільними частинками і приєднуються за подвійним зв'язком C=O. Для перетворення утвореного спочатку алкоксид-іону в спирт після закінчення відновлення в реакційне середовище додають воду.
В промисловості етаналь перетворюють в етанол в результаті каталітичної гідрогенізації. Реакцію проводять, пропускаючи випари альдегіду в суміші з воднем над нікелевим або паладієвим каталізатором.
Альдольно-кротонова конденсація
В результаті взаємодії в лужному середовищі двох молекул етаналю утворюється 3-гідроксибутаналь:
Оскільки продукт реакції містить в молекулі гідроксильну і альдегідну групи, його назвали альдолем (від слів альдегід і алкоголь), а сама реакція конденсації оксосполук в лужному середовищі отримала назву альдольної конденсації. Ця реакція має велике значення в органічному синтезі, оскільки дозволяє синтезувати різні гідроксикарбонільні сполуки. Альдольну конденсацію можна проводити в змішаному варіанті, з використанням різних карбонільних сполук.
Часто альдольна конденсація супроводжується відщепленням води і утворенням α,β-ненасиченої карбонільної сполуки. У такому випадку реакція називається кротоновою конденсацією. Таке часто відбувається, коли реакцію проводять при підвищеній температурі.
Реакція «срібного дзеркала»
Однією із якісних реакцій для визначення альдегідної групи є реакція «срібного дзеркала» — окиснення альдегіду аргентум(I) оксидом. Оксид срібла завжди готовлять безпосередньо перед дослідом, додаючи до розчину аргентум(I) нітрату розчин гідроксиду лужного металу. В розчині амоніаку аргентум(I) оксид утворює комплексну сполуку під назвою гідроксид діамінсрібла або реактив Толленса. При дії цієї сполуки на етаналь відбувається окисно-відновна реакція. Оцтовий альдегід окиснюється до оцтової кислоти, а катіон Аргентуму відновлюється у металічне срібло, яке дає блискучий наліт на стінках пробірки — «срібне дзеркало».
Окиснення гідроксидом міді
_hydroxide_-_Cu(OH)2.jpg.webp)
Ще одна якісна реакція на альдегіди полягає в їх окисненні гідроксиду міді(II). При окисненні альдегіду купрум(II) гідроксид, що має світло-блакитний колір, відновлюється до гідроксид міді(I) жовтого кольору. Цей процес проходить при кімнатній температурі. Якщо підігріти дослідний розчин, то купрум(I) гідроксид жовтого кольору перетворюється в оксид міді(I) червоного кольору.
Галогенування
Наявність в молекулі етаналю електроноакцепторної оксогрупи є причиною підвищеної реакційної здатності атомів Гідрогену, що знаходяться біля атомів Карбону в α-положенні. Вони здатні заміщатися на атоми галогену.
Полімеризація
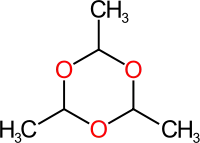
Оцтовий альдегід подібно до формальдегіду здатен полімеризуватися за наявності слідів кислоти. При полімеризації трьох молекул етаналю утворюється паральдегід — рідина з температурою кипіння 124,5 °С. При нагріванні за наявності кислот він деполімеризується з утворенням вихідного оцтового альдегіду.
Взаємодія з амоніаком
Оцтовий альдегід реагує з безводним амоніаком в ефірі, даючи тригідрат гексагідротриазину, який після дегідратації над сульфатною кислотою утворює 2,4,6-триметилгексагідро-1,3,5-триазин, азотний аналог «паральдегіду»[6].
У промисловості етаналь окиснюють до оцтової кислоти і пероцтової кислоти повітрям[7]. Для отримання оцтової кислоти окиснення зазвичай проводять у випарах і при підвищеній температурі. Для отримання пероцтової кислоти реакцію проводять при 0 °С або при більш низькій температурі в розчиннику. Як проміжний продукт утворюється 1-гідроксиетилперацетат, який розкладається з утворенням пероцтової кислоти і оцтового альдегіду. Останній повертають у цикл.
Застосування
Етаналь застосовують в промисловості для виробництва ацетатів целюлози, оцтової і пероцтової кислот, оцтового ангідриду, етилацетату, гліоксалю, 2-етилгексанолу, алкіламінів, бутанолу, пентаеритриту, алкілпіридинів, 1,3-бутиленгліколю, хлоралю. Також використовується як відновник у виробництві дзеркал.
Світове виробництво у 1982 році становило 2 млн т/рік (без СРСР)[8].
Фізіологічна дія
Тварини
Для білих мишей при 2-годинній експозиції ЛК50 = 21,8 мг/л, при введенні в шлунок ЛД50 = 1232 мг/кг[9]. Основні симптоми отруєння — розлад дихання, подразнення слизових оболонок. Вдихання етаналю концентрацією 0,5 мг/л протягом семи годин викликає помітне подразнення слизових оболонок у кішок. При 2 мг/л — сильне подразнення, а 20 мг/л через 1–2 години викликає смерть. Розтин показує набряк і запалення легень. Щурі і морські свинки переносили введення дози 100 мг/кг протягом 6 місяців. При цьому відзначалось порушення умовнорефлекторної діяльності, підвищення артеріального тиску. Ті ж зміни викликала доза 10 мг/кг через 2–3 місяці[9].
Людина
Поріг сприйняття запаху становить 0,0001 мг/л, а вже при 0,004 мг/л відчувається різкий запах[9]. Крім легкого подразнення слизових оболонок від 0,1–0,4 мг/л при хронічній дії етаналю інших патологічних змін не відзначалося. При великих концентраціях спостерігається прискорення пульсу, нічне потовиділення. При дуже великих — задуха, різкий кашель, головні болі, бронхіт, запалення легень. Можливе звикання до невеликих концентрацій.
Потрапляння в організм і перетворення
Затримується у дихальних шляхах кролика в середньому на 60 %, близько 25 % абсорбується у верхніх дихальних шляхах[10]. В організмі окиснюється до оцтової кислоти, яка вступає в нормальний обмін і згорає перетворюється на CO2 і H2O. Швидкість метаболізму велика і у кроликів становить 7–10 мг/хв.[11]. Проміжним продуктом окиснення є ацетон[11].
Примітки
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — С. 362. — ISBN 966-7022-19-6.
- List of Classifications – IARC Monographs on the Identification of Carcinogenic Hazards to Humans. monographs.iarc.who.int. Процитовано 8 квітня 2021.
- Known and Probable Human Carcinogens. www.cancer.org (англ.). Процитовано 8 квітня 2021.
- J. Н. S. Green and D. J. Harrison, Spectrochimica Acta, 1976, 32A, 1265. (англ.)
- А. П. Лузин, С. Э. Зурабян, Р. А. Тюкавкина и др. Органическая химия. — Москва: Медицина, 1998. С. 238. (рос.)
- G. Kynakakou and J. Seyden-Penne, Tetrahedron Letters, 1974, 1737. (англ.)
- W. E. Smith, The Journal of Organic Chemistry, 1972, 37, 3972. (рос.)
- Химическая энциклопедия/Под. ред. Кнунянц И. Л. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 224. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е. Том I. Органические вещества. Под. Ред. Н. В. Лазарева и Э. Н. Левиной, Ленинград, «Химия», 1976. С. 509
- Цай Л. М. Гигиена труда, 1962, № 12, с. 33–36. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Изд. 7-е. Том I. Органические вещества. Под. Ред. Н. В. Лазарева и Э. Н. Левиной, Ленинград, «Химия», 1976. С. 510
Джерела
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — Видання третє. — Львів : Центр Європи, 2006. — С. 361–385. — ISBN 966-7022-19-6.
- Химическая энциклопедия / Под. ред. Кнунянц И. Л. — Москва : Советская энциклопедия, 1988. — Т. 1. — С. 224. (рос.)
- Лузин А. П., Зурабян С. Э., Тюкавкина Н. А. Органическая химия / Под. ред. Тюкавкиной Н. А. — Второе издание. — Москва : Медицина, 1998. — С. 227-249. — ISBN 5-225-04527-8. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. — Ленинград : Химия, 1976. — Т. 1. — С. 509-510. — 49000 прим. (рос.)
- Общая органическая химия / Под. ред. Бартона Д. и Стоддарта Дж. Ф. — Москва : Химия, 1982. — Т. 2. — С. 488-529. (рос.)
- Дж. Робертс, М. Касерио. Основы органической химии. — Второе издание. — Москва : Мир, 1978. — Т. 1. — С. 457-503. (рос.)
- Шабаров Ю. С. Органическая химия. — Москва : Химия, 1994. — Т. 2. — С. 218–269. — 4000 прим. — ISBN 5-7245-0991-1. (рос.)
- Моррисон Р., Бойд Р. Органическая химия. — Москва : Мир, 1974. — С. 810–831. (рос.)
- Ким А. М. Органическая химия. — Новосибирск : Сибирское университетское издательство, 2002. — С. 618-619. — 2400 прим. — ISBN 5-94087-036-8. (рос.)
-oxide-sample.jpg.webp)