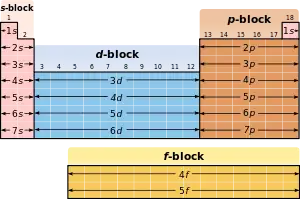
d-елементи
d-елементи — елементи у періодичній таблиці, в електронній оболонці яких валентні електрони з найвищою енергією займають d-орбіталь. Множина таких елементів утворює d-блок: в нього входять елементи від 3 до 12 групи.[1][2] d-елементи заповнюють d-оболонку d-електронами, яка в елементів починається s2d1 (третя група) і закінчується s2d10 (дванадцята група). Однак існують деякі порушення в цій послідовності, наприклад, у Хрому s1d5 (але не s2d4) вся одинадцята група має конфігурацію s1d10 (але не s2d9). Одинадцята група має заповнені s- і d-електрони.
| Група→ | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | |||||||||
| ↓ Період | |||||||||||||||||||
| 4 | 21 Sc |
22 Ti |
23 V |
24 Cr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn | |||||||||
| 5 | 39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd | |||||||||
| 6 | 71 Lu |
72 Hf |
73 Ta |
74 W |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg | |||||||||
| 7 | 103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 Hs |
109 Mt |
110 Ds |
111 Rg |
112 Cn | |||||||||
d-елементи також відомі як перехідні метали або перехідні елементи. Однак точні межі, що відокремлюють перехідні метали від інших груп хімічних елементів, ще не проведені. Хоча деякі автори вважають, що елементи, що входять до d-блок, є перехідними елементами [1], в яких d-електрони є частково заповненими або в нейтральних атомах або іонах, де ступінь окислювання дорівнює нулю.[3] ІЮПАК в даний час приймає такі дослідження як достовірні і повідомляє, що це відноситься тільки до 3–12 груп хімічних елементів.[4] Метали 12ої внаслідок повного заповнення d-оболонки не відповідають класичному визначенню d-елементів, тому їх можна вважати і постперехідними металами. Також переглянуто історичне застосування терміна «перехідні елементи» і d-блоку.[5]
В s-блок і p-блок періодичної таблиці аналогічні властивості, через періоди, як правило, не спостерігаються: найважливіші властивості посилюються по вертикалі у нижніх елементів даних груп. Прикметно, що відмінності елементів входять до d-блок по горизонталі, через періоди, стають вираженішими.
Лютецій і Лоуренсій знаходяться в d-блоці, та вони не вважаються перехідними металами, але лантаноїди й актиноїди, що прикметно, такими вважаються з погляду ІЮПАК.[6]. Дванадцята група хімічних елементів хоч і знаходиться в d-блоці, проте вважається, що елементи, які до неї входять, є постперехідними.[6]
Див. також
Примітки
- R.H. Petrucci, W.S. Harwood, F.G. Herring. «General Chemistry». — С. 341—342.
- C.E. Housecroft и A.G. Sharpe. «Inorganic Chemistry». — 2005. — С. 20—21.
- F.A. Cotton и G. Wilkinson. «Advanced Inorganic Chemistry». — С. 625.
- Международный союз теоретической и прикладной химии. Transition element. Compendium of Chemical Terminology. Архів оригіналу за 8 травня 2012. Процитовано 29 вересня 2011.
- Jensen, William B. (2003). «The Place of Zinc, Cadmium, and Mercury in the Periodic Table». Journal of Chemical Education. с. 952—961. Архів оригіналу за 8 травня 2012. Процитовано 29 вересня 2011.
- IUPAC Provisional Recommendations for the Nomenclature of Inorganic Chemistry. 2004. Архів оригіналу за 27 жовтня 2006. Процитовано 29 вересня 2011.
