Етантіол
Ета́нтіо́л або ети́лмеркапта́н — органічна сполука, представник ряду тіолів складу C2H5SH. За звичайних умов є безбарвною, леткою рідиною із відразливим запахом, що нагадує запах тухлих яєць. Етантіол перебуває у природі як компонент нафти та продукт гниття, його виділяють деякі види устриць. Він малорозчинний у воді, але добре розчинний в більшості органічних розчинників.
| Етантіол | |
|---|---|
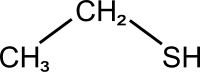 | |
 | |
| Назва за IUPAC | етантіол[1] |
| Інші назви | етилмеркаптан, меркаптоетан |
| Ідентифікатори | |
| Номер CAS | 75-08-1 |
| Номер EINECS | 200-837-3 |
| ChEBI | 46511 |
| RTECS | KI9625000 |
| SMILES |
CCS[2] |
| InChI |
InChI=1S/C2H6S/c1-2-3/h3H,2H2,1H3 |
| Властивості | |
| Молекулярна формула | C2H6S |
| Молярна маса | 62,134 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 0,8315 г/мл |
| Тпл | -147,88 °C |
| Ткип | 35,0 °C |
| Кислотність (pKa) | 10,61 |
| Діелектрична проникність (ε) | 6,667 |
| Показник заломлення (nD) | 1,4310 |
| В'язкість | 0,364 мПа·с (0 °C) 0,287 мПа·с (25 °C) |
| Дипольний момент | 1,61±0,08 Д (гош) 1,58±0,08 Д (транс) |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-73,6 кДж/моль (рід.) -46,1кДж/моль (газ) |
| Ст. ентропія S |
207,0 Дж/(моль·К) (рід.) 296,2 Дж/(моль·К) (газ) |
| Теплоємність, c |
117,9 Дж/(моль·К) (рід.) 72,7 Дж/(моль·К) (газ) |
| Небезпеки | |
| ЛД50 | 4870 мг/кг (пацюки, респіраторно, 4 години) 1034 (пацюки, орально) |
| Температура спалаху | -17 °C |
| Температура самозаймання | 300 °C |
| Вибухові границі | 2,8—18,2% |
| Пов'язані речовини | |
| Пов'язані речовини | етанол |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Етантіол використовується як одорант для природного газу та у виробництві агрохімікатів.
Отримання
Для отримання етантіолу послуговуються переважно реакціями алкілювання сірководню та солей сульфідної кислоти:
Також використовують реакцію приєднання сірководню до етилену у кислому середовищі:
Хімічні властивості
Кислотність етантіолу на декілька порядків вища, ніж у відповідного алканолу — етанолу: значення pKa для цих сполук складає 10,6 та 15,8 відповідно.
При взаємодії з лугами етантіол утворює ряд етантіолятів:
Етантіол легко окиснюється до діалкілдисульфідів або сульфокислот (в залежності від сили окисника):
Також діалкілсульфід можна отримати при взаємодії хлору у надлишку етантіолу:
Аналогічно до спиртів, етантіол реагує з алкілгалогенідами з утворенням естерів:
Взаємодіючи з карбонільними сполуками — альдегідами, кетонами — утворюються меркаптоаналоги ацеталів і кеталів:
При взаємодії з карбоновими кислотами та їхніми похідними етантіол утворює тіоестери:
Під дією будь-якого активного радикала етантіол може віддавати атом гідрогену, утворюючи неактивний радикал:
При розкладанні етантіолу основними продуктами є етилен та сірководень; альтернативний хід реакції веде до утворення радикалів:
Токсичність
Етантіол виявляє посередню токсичність, що показало тестування на тваринах. Низькі концентрації (близько 4 мільйонних часток) викликають подразнення шкіри та очей, головний біль, нудоту, сповільнення дихання. Тривала експозиція при концентрації 4 м.ч. знижує чутливість нюху.
Гранично допустима концентрація складає 0,5 м.ч. (1 мг/м³).
Застосування
Етантіол використовується як одорант побутового газу, котрий не має запаху. Застосовується у синтезі снодійного препарату сульфоналу, а також сільськогосподарських хімікатів (бутилату, циклоату, деметону, дисульфотону, оксидепрофосу, фенотіолу тощо).
Примітки
- IUPAC Provisional Recommendations. — 2004. — P. 9. (англ.)
- Ethanethiol
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Roberts, John S. Thiols // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 24. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Lange's Handbook of Chemistry / Dean, John A., editor. — 15th. — New York : McGraw-Hill, 1999. — ISBN 0-07-016384-7. (англ.)
- Roy, Kathrin-Maria. Thiols and Organic Sulfides // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — DOI: (англ.)
- Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.
- Химический энциклопедический словарь / Под ред. И. Л. Кнунянц. — М. : Сов. энциклопедия, 1983. — 792 с. (рос.)