Йодоводень
Йо́дово́день — неорганічна сполука ряду галогеноводнів складу HI. За звичайних умов є безбарвним отруйним газом, що подразнює слизову оболонку. При розчиненні у воді утворює сильну йодидну кислоту (йодоводневу).
| Йодоводень | |
|---|---|
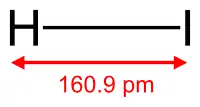 |
 модель молекули |
| Назва за IUPAC | гідроген йодид |
| Інші назви | йодан |
| Ідентифікатори | |
| Номер CAS | 10034-85-2 |
| PubChem | 24841 |
| Номер EINECS | 233-109-9 |
| DrugBank | 15778 |
| KEGG | C05590 |
| ChEBI | 43451 |
| RTECS | MW3760000 |
| SMILES |
I[1] |
| InChI |
InChI=1S/HI/h1H |
| Номер Гмеліна | 814 |
| Властивості | |
| Молекулярна формула | HI |
| Молярна маса | 127,91241 г/моль |
| Зовнішній вигляд | безбарвний газ |
| Густина | 2,85 г/см³ (-4,7 °C) |
| Тпл | –50,80 °C (222,35 K)[2] |
| Ткип | −34,36 °C (237,79 K) |
| Розчинність (вода) | 425 г/л при 20°C |
| Кислотність (pKa) | −11 |
| Показник заломлення (nD) | 1,466 |
| Дипольний момент | 0,38 D |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
6,33 ккал/моль |
| Ст. ентропія S |
49,38 кал/(моль·K) |
| Теплоємність, c |
6,98 кал/(моль·K) |
| Небезпеки | |
| Класифікація ЄС | |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Використовується в органічному та неорганічному синтезах для отримання йодидної кислоти, йодорганічних сполук, а також як відновник.
Фізичні властивості
Йодоводень — безбарвний газ, димить на повітрі з утворенням сильної йодидної кислоти. Добре розчинний у воді (425 об'ємів газу у 1 об'ємі води) Кислота зберігається в темних, щільно закритих посудинах оскільки вступає в реакцію з киснем.
Йодводнева кислота
Йодводнева кислота розчин чистого HI у воді. Комерційна йодводнева кислота звичайно містить 57% HI за масою. Йодводнева кислота є однією з найсильніших кислот.
- HI(г) + H2O(р) → H3O(р)+ + I–(р) Ka ≈ 1010
Йодводнева кислота застосовується тільки в лабораторній практиці.
Отримання
Індустрійне виробництво йодоводню відбувається каталітичною реакцією йоду та водню на платиновій губці при 500 °C:
Іноді як відновник застосовують гідразин або сірководень:
Також йодоводень можна отримати реакцією води з трийодидом фосфору:
Однак ця реакція не підходить для добування газоподібного йодоводню. У лабораторії використовують реакцію взаємодії йоду з декаліном:
Окрім цього йодоводень виділяють з його концентрованих розчинів шляхом їхнього осушування оксидом фосфору.
Хімічні властивості
При нагріванні йодоводень розпадається на прості речовини:
При стоянні на світлі водні розчини HI забарвлюються в бурий колір внаслідок поступового окиснення повітрям і виділення молекулярного йоду:
Йодоводень є сильним відновником:
HI здатний відновити концентровану сульфатну кислоту до сірки або навіть до сірководню:
Подібно до інших галогеноводнів, HI приєднується до кратних зв'язків (реакція електрофільного приєднання):
Примітки
- hydrogen iodide // FDA Substance Registration System — Unique Ingredient Identifier / Food and Drug Administration
- Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. с. 371,432–433. ISBN 0123526515.
Джерела
- Patnaik, P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Handbook of Preparative Inorganic Chemistry / Brauer, G., editor. — 2nd. — New York : Academic Press, 1963. — Vol. 1. — 1859 p. (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)