Йод
Йод (від грец. ιώδης - iodes — схожий кольором на фіалку, фіолетовий) — хімічний елемент з атомним номером 53. Найважчий нерадіоактивний неметал. Найменш електронегативний зі стабільних галогенів. Галоген, що найлегше поляризується. Найважчий елемент, що трапляється в еукаріотичних організмах[1]. Відкрито 1811 року у Франції під час Наполеонівських війн[2].
| Йод (53I) | |||||
|---|---|---|---|---|---|
| Назва, символ, номер | Йод, I, 53 | ||||
| Зовнішній вигляд простої речовини | блискучі темно-коричневі кристали | ||||
 | |||||
| |||||
| Група, період, блок | група 17, період 5, p блок | ||||
| Класифікація | галоген | ||||
| Властивості атома | |||||
| Атомний номер | 53 | ||||
| Атомна маса (молярна маса) |
126,90447 а.о.м. (г/моль) | ||||
| Радіус атома | 136 пм | ||||
| Електр. конфігурація Електронні оболонки |
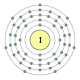 [Kr] 4d10 5s2 5p5 2, 5 | ||||
| Хімічні властивості | |||||
| Ковалентний радіус | 133 пм | ||||
| Іонний радіус | (+7e) 50 (-1e) 220 пм | ||||
| Електронегативність | (за Полінгом): 2.66 | ||||
| Ступені окиснення | 7, 5, 3, 1, 0, -1 | ||||
| Енергія іонізації | (1й e-): 1008,3 кДж/моль | ||||
| Термодинамічні властивості | |||||
| Густина | 4,93 г/см³ | ||||
| Молярний об'єм | 25,7 см³/моль | ||||
Історія
Йод було відкрито випадково у Франції на початку XIX століття. Під час Наполеонівських війн Франція потребувала пороху, однією зі складових якого є калійна селітра (KNO3). Для її виробництва потрібен був поташ (карбонат калію — K2CO3), який добували з попелу дерев та водночас шукали інші джерела для його видобутку.
Французький хімік Б. Куртуа займався екстракцією карбонату калію з попелу деревини. Після екстракції в металевому посуді зазвичай залишалася нерозчинна у воді речовина, що вимивалася гарячою кислотою. Коли Куртуа замінив попіл дерев попелом водоростей, він спостерігав корозію металічного посуду на етапі обробки кислотою. Одного разу коли Куртуа використав більш концентровану, ніж зазвичай, кислоту, він помітив фіолетову пару, що підіймалася з посудини. Пара конденсувалася на стінках посудини у вигляді блискучих фіолетових кристалів, що призводили до корозії.
- 2I- + H2SO4 → I2 + SO32- + H2O
Протягом кількох місяців 1811 року Куртуа досліджував нову речовину, але змушений був припинити свої дослідження через брак коштів. 1812 року Куртуа спонукав своїх друзів Дезорме та Клемо продовжити його дослідження. Зразки речовини також були надіслані Гей-Люссаку та Амперу. 1813 року до Парижу прибули сер Гамфрі Деві з дружиною та прислугою і Майкл Фарадей. Зважаючи на стан війни між Францією та Англією безпека подорожі англійців була гарантована особисто Наполеоном. Під час подорожі Деві отримав від Ампера зразок нової речовини. 6 грудня 1813 року Гей-Люссак висловив припущення, що нова речовина є або елементом, або оксидом. 10 грудня 1813 року Деві надіслав до Лондонського королівського товариства статтю, в який описував свої експерименти, а також висновок, що нова речовина схожа на хлор. Гей-Люссакові здалося, що Деві намагається «застовбити територію», а французи працюють над детальним описом нової речовини, що призвело до конфлікту. Однак Деві та Гей-Люссак визнавали першість Куртуа. 1831 року Куртуа отримав за своє відкриття премію 6000 франків від Інституту Франції[3].
Елемент йод
Хімічні властивості
Належить до 7 групи Періодичної системи хімічних елементів. Формально належить до елементів p-блоку, але не утворює типових π-зв'язків з іншими елементами p-блоку. Натомість для полівалентного йоду властивий іншій тип зв'язку — трицентровий чотириелектронний зв'язок, лінійний зв'язок L-I-L що утворюється між атомом йоду I та двома лігандами L завдяки перекриттю 5p орбіталі йоду та відповідних орбіталів лігандів[4]. У вільному вигляді утворює двоатомні молекули I2. Завдяки відносно високій електронегативності (2,66) йод з більшістю елементів утворює йодиди, формальні похідні йодоводневої кислоти HI, в яких має формальний ступінь окиснення -1. Завдяки здатності атома йоду легко поляризуватися, хімічні зв'язки йоду з більшістю електропозитивних елементів мають значний ковалентний характер. З киснем, фтором та хлором йод утворює неорганічні сполуки із ступенями окиснення +1, +3, +5, +7. Більшість сполук йоду зі ступенем окиснення +1 нестабільні. Існує ряд кислот HIO, HIO2, HIO3, HIO4, які можна вважати прототипами класів сполук з відповідними ступенями окиснення.
Відомо багато органічних сполук, йодокарбонів (англ. Iodocarbons), що містять йод з формальним ступенем окиснення -1 у хімічному зв'язку Карбон-Йод[5].
Завдяки поганій здатності — відносно інших галогенів — утворювати водневі зв'язки, йон I- є найкращим поміж інших галогенідів нуклеофілом в протонних розчинниках і найгіршим — в апротонних[6]. Існує також великий клас полівалентних йодоорганічних сполук що містять йод з формальними ступенями окиснення +3 та +5 у хімічному зв'язку Карбон-Йод. На 2014 рік йодоорганічні сполуки, що містять йод зі ступенем окиснення +7, невідомі[4]. Деякі полівалентні йодоорганічні сполуки, наприклад, 2-йодоксибензойна кислота, здатні до одноелектронного відновлення (SET) з утворенням короткоживучих аніон-радикалів, в яких йод має парний ступінь окиснення[7].
Ізотопи
Відомо 37 ізотопів йоду з масовими числами від 108 до 144. Єдиний стабільний ізотоп — 127І. Єдиний ЯМР-активний ізотоп (спін 5/2) — 127І.[8]
Радіонуклід (нестабільний ізотоп) йод-131 широко застосується в ядерній енергетиці, медичній діагностиці й лікуванні, а також під час видобутку природного газу.
Поширення в природі
У чистому вигляді йод у природі не трапляється. У вигляді сполук трапляється в супутніх розсолах нафтових та газових родовищ у концентраціях, що економічно виправдовують його видобування, а також у морській воді. Власне йодних мінералів мало. Найвідоміші — лаутарит Са(ІО3)2 та йодаргірит AgI. Мінерали йоду легко розчинні, тому йод легко вилуговується з гірських порід, переноситься в моря, де частково накопичується у водоростях-ламінаріях.
Проста речовина йод
Подібно до інших галогенів існує як двохатомна молекула I2. За нормальних умов утворює кристали чорно-сірого кольору з металічним блиском. Погано розчинний у воді, але добре розчиняється у водних розчинах йодидів лужних металів, утворюючи добре розчинні трийодиди I3-. Розчиняється у спиртах, хлороформі, чотирихлористому вуглецю. Розчини йоду в неполярних розчинниках фіолетові. Розчини в полярних розчинниках — брунатні, що свідчить про помітний перенесення заряду під час координації до молекули йоду молекули розчинника, що діє як основа Льюїса.
Отримання
Основна частина йоду у світі виробляється в Чилі та Японії. У Чилі йод видобувають із йодату кальцію Ca(IO3)2, який отримують за допомогою лужного розчину з каліче, що, своєю чергою, трапляється в селітряних шахтах Атакамської пустелі. Розчин Ca(IO3)2 реагує з діоксидом Сульфуру з утворенням HI, яку далі окислюють у розчині йодатною кислотою з виділенням йоду:
У Японії йод видобувають із розсолів, які супроводжують газові родовища. Розсіл обробляють газом хлору, після чого йод, що утворюється, видувається повітрям з реактору. Також застосовується виділення йоду за допомогою аніонно-обмінних смол.

Застосування йоду та його сполук
В аналітичній хімії
Йодометрія. Якісна реакція на алкени. Якісна реакція на крохмаль та глікоген.
У медицині
Як антисептик використовують 5 % спиртовий розчин йоду.
Відхаркувальне. Кольпоскопія. Рентгеноконтрастні препарати.
У техніці та промисловості
Фотографія, виробництво барвників, освітлення, акумулятори, засів хмар. Гелій-неоновий лазер.
Біологічна роль
Як мікроелемент йод потрібен людині для утворення гормонів тироксину та трийодтироніну, що синтезуються фолікулярними клітинами щитоподібної залози.
Йод в організмі людини бере участь у регуляції: енергетичного обміну, температури тіла; швидкості біохімічних реакцій; обміну білків, жирів, водно-електролітного обміну; метаболізму деяких вітамінів; процесів росту і розвитку організму, включаючи нервово-психічний розвиток. Крім того, йод підвищує споживання кисню тканинами.
Нестача йоду в організмі людини призводить до йододефіциту — комплексного розладу здоров'я, що є одним з найпоширеніших у світі неінфекційних захворювань.
Токсичність
При вдиханні пари йоду розвивається ураження верхніх дихальних шляхів, виникають сильні напади кашлю, біль у грудях, головний біль. При потраплянні концентрованих розчинів йоду всередину розвиваються опіки стравоходу, шлунку, слизові набувають темно-бурого кольору.
- Невідкладна допомога у разі отруєння:
- при вдиханні пари йоду: винести хворого з ураженого приміщення: кисень, під шкіру атропін (1 мл 0,1 % розчину), ефедрин (1 мл 5 % розчину), димедрол (2 мл 1 % розчину), в/в хлорид кальцію (10 мл 10 % розчину), еуфілін (10 мл 2,4 % розчину).
- при потраплянні йоду всередину — промивання шлунку через зонд 0,5 % розчином тіосульфату натрію. В/в крапельно тіосульфат натрію (300 мл 30 % розчину). Протишокова терапія.
Радіонуклід 131I становить найбільшу небезпеку у радіоактивних викидах після аварій на АЕС[9][недоступне посилання з 15.06.2018]. Ураження радіоактивним йодом може призводити до розвитку раку щитоподібної залози.
Див. також
Примітки
- Ultratrace minerals http://handle.nal.usda.gov/10113/46493
- Küpper, F. C., Feiters, M. C., Olofsson, B., Kaiho, T., Yanagida, S., Zimmermann, M. B., Carpenter, L. J., Luther, G. W., Lu, Z., Jonsson, M. and Kloo, L. «Commemorating Two Centuries of Iodine Research: An Interdisciplinary Overview of Current Research». DOI:10.1002/anie.201100028
- Louis Rosenfeld «Discovery and Early Uses of Iodine» DOI:10.1021/ed077p984
- Viktor V. Zhdankin «Hypervalent Iodine Chemistry: Preparation, Structure and Synthetic Applications of Polyvalent Iodine Compounds» DOI:10.1002/9781118341155
- Hughes C. , Malin G. , Turley C. M. , Keely B. J. , Nightingale P. D. «The production of volatile iodocarbons by biogenic marine aggregates» DOI:10.4319/lo.2008.53.2.0867
- The Most Annoying Exceptions in Org 1 (Part 1) http://www.masterorganicchemistry.com/2011/02/01/the-most-annoying-exceptions-in-org-1-part-1/
- K. C. Nicolaou, T. Montagnon, P. S. Baran, and, and Y.-L. Zhong «Iodine(V) Reagents in Organic Synthesis. Part 4. o-Iodoxybenzoic Acid as a Chemospecific Tool for Single Electron Transfer-Based Oxidation Processes» DOI:10.1021/ja012127+
- http://chem.ch.huji.ac.il/nmr/techniques/1d/row5/i.html
- Экологические последствия аварии на Чернобыльской АЭС и их преодоление: двадцатилетний опыт Архівовано 1 травня 2012 у Wayback Machine.(рос.)
Література
- Антоняк Г. Л., Влізло В. В. Біохімічна та геохімічна роль йоду : монографія. – Львів : ЛНУ імені Івана Франка, 2013. – 392 с. – (Серія "Біологічні Студії"). – ISBN 978-966-613-752-7 (серія), 978-617-10-0042-1
- Глосарій термінів з хімії / уклад. Й. Опейда, О. Швайка ; Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Дон. : Вебер, 2008. — 738 с. — ISBN 978-966-335-206-0.
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Донбас, 2004. — Т. 1 : А — К. — 640 с. — ISBN 966-7804-14-3.
- Commemorating Two Centuries of Iodine Research: An Interdisciplinary Overview of Current Research // Frithjof C. Küpper, Martin C. Feiters, Berit Olofsson, Tatsuo Kaiho, Shozo Yanagida, Michael B. Zimmermann, Lucy J. Carpenter, George W. Luther III, Zunli Lu, Mats Jonsson, Lars Kloo — Angewandte Chemie International Edition, 2011 DOI: 10.1002/anie.201100028

