Молнупіравір
Молнупіравір англ. Molnupiravir, відомий також як MK-4482 або EIDD-2801 — синтетичний експериментальний противірусний препарат, який застосовується перорально та розроблений для лікування грипу. За хімічним складом молнуправір є проліками та похідним синтетичного нуклеозиду N4-гідроксицитидину, механізм його дії полягає у створенні помилок копіювання під час реплікації вірусної РНК.[1][2] Молнупіравір також є активним проти коронавірусів, зокрема SARS, MERS та SARS-CoV-2.
 | |
| Систематична назва (IUPAC) | |
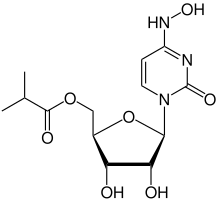
| ((2R,3S,4R,5R)-3,4-dihydroxy-5-(4-(hydroxyimino)-2-oxo-3,4-dihydropyrimidin-1(2H)-yl)tetrahydrofuran-2-yl)methyl isobutyrate | |
| Ідентифікатори | |
| Номер CAS | |
| Код ATC | ? |
| PubChem | |
| Хімічні дані | |
| Формула | C13H19N3O7 |
| Мол. маса | 329,31 г/моль |
| SMILES | & |
| Фармакокінетичні дані | |
| Біодоступність | НД |
| Метаболізм | НД |
| Період напіврозпаду | НД |
| Виділення | НД |
| Терапевтичні застереження | |
| Кат. вагітності | |
| Лег. статус |
? (US) |
| Використання | перорально |
Препарат був розроблений в Університеті Еморі університетською компанією з розробляння інноваційних препаратів «Drug Innovation Ventures at Emory» (DRIVE). Пізніше права на нього придбала компанія «Ridgeback Biotherapeutics», що базується в Маямі, яка згодом співпрацювала з «Merck & Co.» у подальшому дослідженні та маркетингу препарату.
Суперечка щодо безпечності препарату
У квітні 2020 року колишній керівник Управління з передових досліджень та розробок біомедичних досліджень США Рік Брайт виступив із заявою, в якій виявив занепокоєння з приводу фінансування подальшого розвитку молнупіравіру у зв'язку з тим, що подібні на молнупіравір за хімічною структурою препарати мають мутагенні властивості (можуть пошкоджувати ДНК).[3] Попередня компанія, яка займалась дослідженням препарату, «Pharmasset», відмовилась від нього. Генеральний директор DRIVE Джордж Пейнтер заперечив ці твердження, зазначивши, що проводились дослідження токсичності молнупіравіру, які надані регуляторним органам США та Великої Британії, які дозволили продовжити дослідження безпеки препарату для людей навесні 2020 року. Також у цей час DRIVE та «Ridgeback Biotherapeutics» заявили, що планують майбутні дослідження безпеки препарату для тварин.[4]
Застосування препарату в лікуванні коронавірусної хвороби 2019
Після виявлення активності проти SARS-CoV-2 у березні 2020 року молнупіравір тестувався у попередньому дослідженні на людях щодо безпечності, переносимості та фармакокінетики препарату на здорових добровольцях у Великій Британії та США.[5] У червні 2020 року «Ridgeback Biotherapeutics» повідомила, що переходить до II фази клінічного дослідження для перевірки ефективності препарату для лікування COVID-19.[6] У липні 2020 року пройшли два дослідження на невеликій кількості госпіталізованих та негоспіталізованих хворих у США та Великій Британії.[7][8] Наприкінці липня 2020 року, ще не оприлюднивши жодних медичних даних, компанія «Merck & Co.», яка співпрацювала з компанією «Ridgeback Biotherapeutics» у дослідженні препарату, оголосила про свій намір провести пізніше дослідження молнупіравіру, починаючи з вересня 2020 року.[9] 19 жовтня 2020 року «Merck» розпочав однорічне дослідження препарату ІІ—ІІІ фази на госпіталізованих хворих.[10]
3 грудня 2020 року в журналі «Nature» була опублікована стаття про результати дослідження щодо застосування молнупіравіру в тхорів, інфікованих COVID-19.[11] Дослідження показало, що препарат був ефективним при пероральному застосуванні у заражених тхорів і що він блокував передачу вірусу між тхорами через 24 години після застосування препарату.
4 листопада 2021 року препарат був затверджений як таблетки для лікування коронавірусу у Великій Британії.[12]
Див. також
Примітки
- Toots M, Yoon JJ, Cox RM, Hart M, Sticher ZM, Makhsous N, Plesker R, Barrena AH, Reddy PG, Mitchell DG, Shean RC, Bluemling GR, Kolykhalov AA, Greninger AL, Natchus MG, Painter GR, Plemper RK (Жовтень 2019). Characterization of orally efficacious influenza drug with high resistance barrier in ferrets and human airway epithelia. Science Translational Medicine 11 (515): eaax5866. PMC 6848974. PMID 31645453. doi:10.1126/scitranslmed.aax5866. (англ.)
- Toots M, Yoon JJ, Hart M, Natchus MG, Painter GR, Plemper RK (Квітень 2020). Quantitative efficacy paradigms of the influenza clinical drug candidate EIDD-2801 in the ferret model. Translational Research 218: 16–28. PMC 7568909. PMID 31945316. doi:10.1016/j.trsl.2019.12.002. (англ.)
- Halford, Bethany. An emerging antiviral takes aim at COVID-19. Процитовано 1 серпня 2020. (англ.)
- Cohen, Jon; Piller, Charles (13 травня 2020). Emails offer look into whistleblower charges of cronyism behind potential COVID-19 drug. Science. Процитовано 1 серпня 2020. (англ.)
- COVID-19 First In Human Study to Evaluate Safety, Tolerability, and Pharmacokinetics of EIDD-2801 in Healthy Volunteers. ClinicalTrials.gov. Процитовано 1 червня 2020. (англ.)
- Ridgeback Biotherapeutics Announces Launch of Phase 2 Trials Testing EIDD-2801 as Potential Treatment for COVID-19. Business Wire. Процитовано 4 липня 2020. (англ.)
- A Safety, Tolerability and Efficacy of EIDD-2801 to Eliminate Infectious Virus Detection in Persons With COVID-19. ClinicalTrials.gov. Процитовано 4 липня 2020. (англ.)
- The Effect of EIDD-2801 on Viral Shedding of SARS-CoV-2 (COVID-19). ClinicalTrials.gov. Процитовано 4 липня 2020. (англ.)
- Court, Emma (31 липня 2020). Merck pushes ahead on COVID-19 treatment, vaccines. Процитовано 31 липня 2020. (англ.)
- ClinicaL trials register : Efficacy and Safety of Molnupiravir (MK-4482) in Hospitalized Adult Participants With COVID-19 (MK-4482-001) (англ.)
- Therapeutically administered ribonucleoside analogue MK-4482/EIDD-2801 blocks SARS-CoV-2 transmission in ferrets (англ.)
- Британія першою у світі схвалила таблетки від коронавірусу, УП, 4 листопада 2021