Нестандартні амінокислоти
Нестандартні амінокислоти — амінокислоти, виявлені в живих організмах, як у складі білків, так і вільних, які не входять до числа основних 20 амінокислот, що кодуються «стандартним» генетичним кодом. Нестандартні амінокислоти у складі білків можуть включаються до поліпептидного ланцюжка як під час трансляції (подібно до стандартних), так і утворюватися із стандартних амінокислот в результаті посттрансляційної модифікації, тобто додаткових ферментативних реакцій.
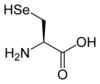 |
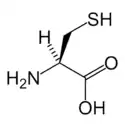 |
| Структурні формули селеноцистеїну (ліворуч) і цистеїну (праворуч). | |
До числа амінокислот, що вставляються протягом трансляції, входять лише дві відомі амінокислоти: селеноцистеїн[1][2] (знайдений у всіх основних групах живих організмів) і пірролізин[3] (знайдений лише у деяких видіх метаногенних архей, де вона використовується в ферментах, що розщеплюють метан). Ці амінокислоти, як і стандартні, мають відповідну їм тРНК, здібну приєднуватися до відповідного кодону. Селеноцистеїн кодується кодоном UGA, а пірролізин — кодоном UAG, оба зазвичай служать стоп-кодонами, проте за наявністю певних регуляторних послідовностей мРНК, можуть приєднувати відповідну тРНК і синтезувати нестандарні амінокислоти.
Переважна більшість нестандартних амінокислот не кодується безпосередньо в ДНК і мРНК, а створюються вже після трансляції. Прикладами амінокислот цієї групи є 4-гідроксипролін, 5-гідроксилізин, десмозин, N-метиллізин, цитрулін, гомоцистеїн, метильовані та фосфорильовані форми деяких стадартних амнінокислот та інші. Процеси, що приводять до утворення цих амінокислот, можуть бути досить різними, крім того, може бути більше одного шляху утворення певної амінокислоти. Так, гомоцистеїн може утворюватися як з цистеїну в результаті транссірчаного шляху, так і з метіоніну в результаті деметилювання через промужну стадію S-аденозил-метіоніну[4]. Багато амінокислот модифікуються зворотно, за допомогою процесів фосфорилювання і метилювання, такі модифікації часто служать для зміни активності білка, що містить ці амінокислоти.
Багато нестандартних амінокислот не входять до складу білків, а використовуються незалежно. Прикладами таких амінокислот є лантіонін, 2-аміноізомасляна кислота, дегідроаланін, гамма-аміномасляна кислота (ГАМК), дофамін. Часто амінокислоти можуть зустрічатися як в білках, так і у вільному стані. Ці амінокислоти часто є посередниками в метаболічних шляхах та сигнальними молекулами — наприклад, орнітин і цитрулін беруть участь в циклі сечовини, частині катаболізму амінокислот[5]. ГАМК і дофамін є нейротрансмітером і гормоном відповідно.
Посилання
- F. Zinoni, A. Birkmann, T. C. Stadtman and A. Bock (1986). Nucleotide Sequence and Expression of the Selenocysteine-Containing Polypeptide of Formate Dehydrogenase (Formate-hydrogen-lyase-Linked) from Escherichia coli. PNAS 83 (13): 4650–4654. PMID 2941757.
- Driscoll D, Copeland P (2003). Mechanism and regulation of selenoprotein synthesis.. Annu Rev Nutr 23: 17–40. PMID 12524431.
- John F. Atkins and Ray Gesteland (2002). The 22nd Amino Acid. Science 296 (5572): 1409 – 1410. PMID 12029118. doi:10.1126/science.1073339.
- Brosnan J, Brosnan M (2006). The sulfur-containing amino acids: an overview. J Nutr 136 (6 Suppl): 1636S–1640S. PMID 16702333.
- Curis E, Nicolis I, Moinard C, Osowska S, Zerrouk N, Bénazeth S, Cynober L (2005). Almost all about citrulline in mammals. Amino Acids 29 (3): 177–205. PMID 16082501.