Цикл сечовини
Цикл сечовини́, орніти́новий цикл або цикл Кре́бса-Гензеля́йта — метаболічний шлях перетворення токсичного аміаку, що утворюється, в процесі обміну амінокислот, у сечовину. Сечовина є кінцевим продуктом азотистого метаболізму у більшості наземних тварин, які об'єднуються назвою уреателічні організми (на противагу амонотелічним, що виділяють аміак, та урикотелічним, що виділяють сечову кислоту). Цикл сечовини відбувається майже винятково у печінці, звідки його кінцевий продукт — сечовина — транспортується кров'ю до нирок, де відбувається її екскреція із сечею[1][2]. Організм людини виділяє близько 10 кг сечовини за рік[3].
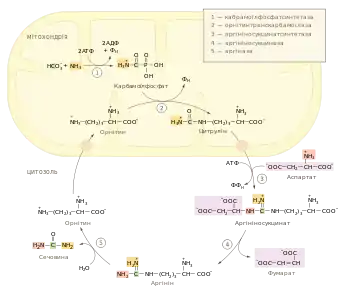
Цикл сечовини був відкритий 1932 року Гансом Кребсом та Куртом Гензеляйтом (нім. Kurt Henseleit) і став першим відомими циклічним метаболічним шляхом[4]. Пізніше індивідуальні реакції описали Сара Ратнер та Філіп Коен[2]. Цикл сечовини складається із п'яти реакцій, дві з яких протікають у матриксі мітохондрій, а три — у цитозолі. Сумарне рівняння метаболічного шляху:
Із двох атомів Нітрогену, що входять до складу сечовини, один походить із аміаку, а інший — із аспартату. Атом Карбону — із бікарбонату[2].
Реакції циклу сечовини
Цикл сечовини починається у матриксі мітохондрій печінки. Внаслідок окисного деамінування амінокислот (переважно L-глутамату) та розщеплення глутаміну до глутамату тут утворюється аміак, частина іонів NH+4 також надходять до печінки ворітною веною від кишківника, де вони є продуктом окиснення амінокислот бактеріями[1]. Не в залежності від походження аміак у мітохондріях відразу ж використовується для синтезу карбамоїлфосфату разом із вуглекислим газом у формі HCO-3, що утворюється внаслідок дихання. Реакція каталізується регуляторним ферментом карбамоїлфосфатсинтетазою I[5], протікає в три стадії:
- Активація бікарбонату АТФ, внаслідок чого утворюється карбоксифосфат та АДФ;
- Нуклеофільна атака NH3 на карбоксифосфат, в якому він замінює фосфатну групу, продуктами є карбамат та фосфатна кислота;
- Фосфорилювання карбамату другою молекулою АТФ з утворенням карбамоїлфосфату та АДФ[2][6].
Оскільки в реакції використовуються дві молекули АТФ вона є незворотною і виступає лімітуючою стадією циклу сечовини[2]. Для здійснення каталізу карбамоїлфосфатсинтетаза I ссавців потребує наявності N-ацетилглутамату[6].
Карбамоїлфосфат виступає активованим донором карбамоїльної групи, що переноситься на орнітин з утворенням цитруліну ферментом орнітинтранскарбамоїлазою. Після цього цитрулін транспортується у цитозоль. Тут він вступає в реакцію конденсації із аспартатом (що утворюється у мітохондріях в процесі переамінування та переноситься у цитозоль), продуктом якої є аргініносукцинат. Каталізує взаємодію між аміногрупою аспартату та карбонільною групою цитруліну аргініносукцинатсинтетаза (АСС)[5]. Енергією цю реакцію забезпечує спряжений гідроліз АТФ до АМФ та пірофосфту, який пізніше також підлягає розщепленню[6].
Аргініносукцинат розщеплюється аргінносукциназою до вільного аргініну та фумарату. Останній транспотрується до мітохондрій, де поповнює пул метаболітів циклу Кребса, або використовується для глюконеогенезу[7]. В останній реакції циклу сечовини на аргінін діє фермент аргіназа, що розщеплює його до сечовини та орнітину. Орнітин переноситься у матрикс мітохондрій та вступає у наступний оберт циклу сечовини[5].
Мітохондріальні та цитоплазматичні ферменти циклу сечовини утворюють кластери, в яких продукт однієї реакції безпосередньо передається активному центру ферменту, що каталізує наступну (див. метаболон). Таким чином, як цитрулін, так і аргініносукцинат, аргінін та орнітин підлягають каналюванню і не розчиняється у цитозолі. У загальний пул метаболітів вивільняється тільки сечовина[5].
Зв'язок із іншими метаболічними шляхами

Цикл сечовини пов'язаний із циклом трикарбонових кислот спільним метаболітом — фумаратом. Тому ці метаболічні шляхи інколи об'єднують під назвою біцикл Кребса (англ. Krebs bicycle — буквально велосипед Кребса). Проте кожен цикл може протікати окремо від іншого, а взаємодія між ними залежить від транспорту проміжних продуктів між мітохондріями та цитозолем. Кілька ферментів ЦТК, такі як фумараза та малатдегідрогеназа, присутні також і в цитозолі, через це фумарат, утворений у циклі сечовини може перетворюватись до малату[8]. Далі малат або окснюється до оксалоацетату, який вступає у глюконеогенез[3], або транспортується до мітохондрій і вступає в ЦТК[8].
Аспартат, що утворюється у мітохондріях у реакції переамінування між оксалоацетатом та глутаматом, може переноситись у цитозоль, де він виступає донором Нітрогену в реакції синтезу аргініносукцинату. Ці реакції об'єднують під назвою аспартат-аргініносукцинатний шунт, що забезпечує зв'язок між окремими метаболічними шляхами, за якими перетворюються аміногрупи та карбонові скелети амінокислот[8].
Загалом для протікання циклу сечовини необхідний еквівалент чотирьох молекул АТФ. Проте в цьому шляху також відбувається перетворення оксалоацетату до фумарату через аспартат, пізніше оксалоацетат регенерується, що супроводжується відновленням однієї молекули НАД+. Кожна молекула НАДH може давати 2,5 АТФ у процесі окисного фосфорилювання. Таким чином загальна енергетична ціна циклу сечовини знижується[9]. Решта енергії постачається окисненням ацетил-КоА, утвореним із карбонових скелетів амінокислот[7].
Регулювання активності циклу сечовини
Активність протікання циклу сечовини контролюється на двох рівнях: короткочасне пристосування до змінних потреб організму відбувається завдяки алостеричній регуляції, а довготривале — шляхом зміни експресії генів, що кодують ферменти цього метаболічного шляху[10].
Перший фермент циклу сечовини — карбамоїлфосфатсинтетаза I — є алостеричним ферментом і активується під впливом N-ацетилглутамату. Останній синтезується N-ацетилглутаматсинтазою із ацетил-КоА та глутамату. У мікроорганізмів та рослин із цієї реакції розпочинається шлях de novo синтезу аргініну із глутамату, проте у ссавців бракує інших ферментів цього шляху, через що активність N-ацетилглутаматсинтази має винятково регуляторну роль. Концентрація N-ацетилглутамату залежить від рівня ацетил-КоА та глутамату, а також аргініну, що активує N-ацетилглутаматсинтазу[10]. Глутамат має особливе значення для пришвидшення протікання циклу сечовини, оскільки його концентрація підвищується в умовах інтенсивного катаболізму амінокислот, за яких він утворюється в реакціях переамінування. Інші ферменти циклу сечовини регулюються концентраціями власних субстратів[11].
Рівень експресії генів всіх п'яти ферментів циклу сечовини суттєво зростає в гепатоцитах, в умовах, коли розщеплення амінокислот в організмі відбувається із високою швидкістю. Наприклад, при вживанні багатої на білки дієти або під час голодування, коли запаси вуглеводів та ліпідів вже не можуть забезпечувати енергетичні потреби організму. У тварин, що харчуються у достатній кількості їжею багату на небілкові енергетичні субстрати, рівень ферментів циклу сечовини у печінці знижений[10].
Спадкові дефекти ферментів циклу сечовини
Спадкові дефекти у гені будь-якого із ферментів циклу сечовини має наслідком підвищену концентрацію амонію в крові (гіперамоніємія), також в організмі може накопичуватись один із проміжних метаболітів цього шляху, в залежності від того який саме фермент ушкоджений. Деякі із цих захворювань проявляються на перший-другий день після народження у формі летаргії та періодичного блювання. Без лікування згодом може наступити кома та незворотні ушкодження головного мозку[12].
Пацієнти із дефектами ферментів циклу сечовини не можуть переносити дієти багатої на білки, проте безбілкова дієта не є опцією, оскільки організм потребує джерела незамінних амінокислот. Лікування залежить від того, який саме елемент шляху ушкоджений. Наприклад негативні ефекти нестачі аргініносукцинази можна подолати вживанням великої кількості аргініну у поєднанні із дієтою з невеликою кількістю білків. У печінці аргінін розщеплюється до сечовини та орнітину, останній приєднує карбамоїлфосфат, перетворюючись у цитрулін. А той у свою чергу підлягає конденсації із аспартатом, продукт цієї реакції — аргініносукцинат екскретується із організму. Отже за таких умов формою виділення Нітрогену із організму є у першу чергу аргініносукцинат[12].
Інший підхід використовується при лікуванні нестачі карбамоїлфосфатсинтази та орнітинтранскарбамоїлази. Під час цих порушень надлишковий Нітроген накопичується у вигляді гліцину та глутамату. Позбутись його допомагає бідна на білки дієта із високим вмістом бензоату та фенілацетату[12] (або фенілбутирату[9]). Бензоат активується до бензоїл-КоА, після чого взаємодіє із гліцином з утворенням гіпурату. Схожим перетворенням підлягає фенілацетат, який спершу активується до фенілацетил-КоА, а опісля з'єднується із глутаміном формуючи фенілацетилглутамін. Обидва кон'югати (гіпурат та фенілацетилглутамін) виводяться із організму із сечею, і слугують замінниками сечовини як форми виведення надлишку Нітрогену[12].
Примітки
- Nelson et al, 2008, с. 682.
- Voet et al, 2011, с. 1025.
- Berg et al, 2007, с. 663.
- Berg et al, 2007, с. 661.
- Nelson et al, 2008, с. 684.
- Berg et al, 2007, с. 662.
- Voet et al, 2011, с. 1028.
- Nelson et al, 2008, с. 684—685.
- Nelson et al, 2008, с. 686.
- Nelson et al, 2008, с. 685.
- Voet et al, 2011, с. 1029.
- Berg et al, 2007, с. 665.
Джерела
- Berg JM, Tymoczko JL, Stryer L (2007). Biochemistry (вид. 6th). W.H. Freeman and Company. ISBN 0-7167-8724-5.
- Nelson D.L., Cox M.M. (2008). Lehninger Principles of Biochemistry (вид. 5th). W. H. Freeman. ISBN 978-0-7167-7108-1.
- Voet D., Voet J.G. (2011). Biochemistry (вид. 4th). Wiley. с. 487—496. ISBN 978-0470-57095-1.
- Губський Ю.І. (2007). Біологічна хімія. Київ-Вінниця: Нова книга. с. 191. ISBN 978-966-382-017-0.
