Нітрит калію
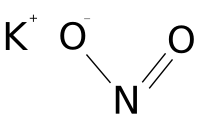
Нітри́т ка́лію (азотистокислий калій) — калієва сіль азотної кислоти з формулою K N O2. Є білим або ледь жовтуватим кристалічним гігроскопічним порошком. Дуже добре розчиняється у воді. На повітрі повільно окислюється до нітрату калію KNO3. Харчова добавка E249. Використовується для поліпшення забарвлення та консервації продуктів в харчовій промисловості.
| Нітрит калію | |
|---|---|
 | |
 | |
| Назва за IUPAC | Potassium nitrite |
| Систематична назва | Нітрат калію |
| Інші назви | Азотистокислий калій |
| Ідентифікатори | |
| Номер CAS | 7758-09-0 |
| PubChem | 516910 |
| Номер EINECS | 231-832-4 |
| RTECS | TT3750000 |
| SMILES |
N(=O)[O-].[K+] |
| InChI |
1S/K.HNO2/c;2-1-3/h;(H,2,3)/q+1;/p-1 |
| Властивості | |
| Молекулярна формула | KNO2 |
| Молярна маса | 85,10 г/моль |
| Зовнішній вигляд | прозорі (білі) кристали |
| Густина | 1,915 г/см³ |
| Тпл | 440; 441 |
| Розчинність (вода) | 280 г/100 мл (0 °C) 413 г/100 мл (100 °C) |
| Розчинність (етанол) | розчиняється |
| Структура | |
| Кристалічна структура | моноклінна сингонія |
| Небезпеки | |
| ЛД50 | 200 мг/кг (кролики, перорально) |
| ГГС піктограми |     |
| ГГС формулювання небезпек | небезпечно |
| R-фрази | R8, R25, R50, R40 |
| S-фрази | S45, S61 |
| Головні небезпеки | головні_небезпеки |
| NFPA 704 |
 0
2
2
|
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Властивості
Нітрит калію утворює безбарвні або ледь жовтуваті дуже гігроскопічні кристали, моноклінної сингонії, просторова група I m, параметри комірки a = 0,677 нм, b = 0,499 нм, c = 0,445 нм, β = 101,75°, Z = 2.
Дуже добре розчинний у воді, розчинення супроводжується зниженням температури. Розчин є слаболужним через гідроліз за аніоном.
Кристали руйнуються за 360 °C (до досягнення точки плавлення, яка становить 440 °C або 441 °C за 100 кПа і за 438 °C за тиску в 101325 Па[1], ентальпія плавлення —17 кДж/моль).
За температури, вищої від даної, розкладається за схемою:
Як і нітрит натрію є окислювачем, особливо за підвищених температур, і реагує з металами, як-от з алюмінієм (активніше взаємодіє з його порошкоподібною формою), зневодненими сполуками амонію, наприклад сульфатом амонію, ціанідами й багатьма органічними сполуками.
На повітрі повільно окислюється до нітрату калію:
Нітрити можна виявити за якісною реакцією з сульфатом заліза (II) в присутності концентрованої сірчаної кислоти (утворюється коричневе забарвлення).
Наявність в природі й способи отримання
У природі нітрити з'являються на проміжних етапах азотного циклу — при нітрифікації (приєднання азоту до сполук) і при денітрифікації (відщепленні азоту від сполук). У промисловості нітрит калію отримують за допомогою реакції оксидів азоту з гідроксидом калію.
Утворюється за окислення свинцю нітратом калію:
або в процесі термічного розкладу:
Застосування
- Нітрит калію використовується як харчова добавка Е249 (консервант), аналогічно іншим нітритам і солям (хлориду і нітриту натрію) — запобігає утворенню ботулотоксину (продукт життєдіяльності палички Clostridium botulinum). При додаванні до м'яса утворює нітрозоміоглобін, що має характерний червоний колір, який можна спостерігати в більшості харчових продуктів (ковбаси, сосиски, та ін.). Вживання продуктів, що містять нітрит калію, викликає спрагу.
- У Європейському союзі продаж нітриту калію для харчових продуктів дозволена лише у вигляді суміші з харчовою сіллю, з вмістом нітриту близько 0,6 %[2].
- Нітрит калію застосовується для діазотування у виробництві азобарвників.
- Нітрит калію застосовується в аналітичній хімії для розпізнавання амінів.
- Нітрит калію застосовується у фотографії як сенсибілізатор.
Біологічна дія
 Токсичний при ковтанні, при вживанні великих доз викликає подразнення, ціаноз, конвульсії та навіть смерть (через утворений метгемоглобін). Подразнює шкіру й очі. Летальна доза LD50 для кроликів 200 мг/кг[3][4].
Токсичний при ковтанні, при вживанні великих доз викликає подразнення, ціаноз, конвульсії та навіть смерть (через утворений метгемоглобін). Подразнює шкіру й очі. Летальна доза LD50 для кроликів 200 мг/кг[3][4].
Надходження нітритів з їжею оцінюється в 31—185 або 40—100 мг на день[5].
У питній воді згідно з вимогами ВООЗ 1970 і 2004 рр.[6][7] допускається вміст нітритів не більше 44—50 мг/літр[8].
Прийнятне споживання нітритів для людей — 3,7—7 мг/кг.[8]
Примітки
- Фізичні величини: Довідник/А. П. Бабічев, Н. А. Бабушкіна, А. М. Братковський та ін.; Під ред. І. С. Григор'єва, Є. З. Мейліхова. — М.; Вища школа, 1991—1232 с — ISBN 5-283-04013-5
- OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
- Material Safety Data Sheet Potassium nitrite MSDS# 19480 Архівовано 8 серпня 2016 у Wayback Machine.. Fisher Scientific. 2005
- http://www.cdc.gov/niosh/ipcsneng/neng1069.html POTASSIUM NITRITE — The National Institute for Occupational Safety and Health (NIOSH), CDC
- Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. «DIETARY NITRATE AND NITRITE INTAKE ESTIMATES»
- World Health Organization. Recommendations; nitrate and nitrite. In: Guidelines for drinking water quality. 3rd ed. Geneva, Switzerland: WHO, 2004:417-20.
- Nitrate and nitrite in drinking-water (WHO/SDE/WSH/07.01/16/Rev/1), 2011
- Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. POTENTIAL HEALTH RISKS OF EXCESSIVE NITRATE AND NITRITE EXPOSURE
Література
- Довідник хіміка / Редкол.: Нікольський Б. П. та ін. — 2-е вид., випр. — М.-Л.: Хімія, 1966. — Т. 1. — 1072 с.
- Довідник хіміка / Редкол.: Нікольський Б. П. та ін. — 3-е вид., випр. — М.-Л.: Хімія, 1971. — Т. 2. — 1168 с.
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans Том 94 «Проковтнуті нітрати та нітрити й токсини ціанобактеріальних пептидів», IARC, 2010 ISBN 978-92-832-1294-2, ISSN 1017—1606