Нітрат калію
Нітрат калію (калійна селітра) — сіль азотної кислоти. Білий кристалічний порошок, без запаху. У природі утворює мінерал, який називають калійною (або індійською) селітрою. У харчовій промисловості зареєстрований як консервант Е252.
| Нітрат Калію | |
|---|---|
 | |
 Potassium nitrate | |
| Назва за IUPAC | Нітрат Калію |
| Інші назви | Калійна селітра |
| Ідентифікатори | |
| Номер CAS | 7757-79-1 |
| PubChem | 24434 |
| Номер EINECS | 231-818-8 |
| DrugBank | 11090 |
| KEGG | D02051 |
| ChEBI | 63043 |
| RTECS | TT3700000 |
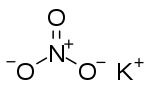
| SMILES |
[K+].[O-][N+]([O-])=O |
| InChI |
1/K.NO3/c;2-1(3)4/q+1;-1 |
| Номер Бельштейна | 16014598 |
| Властивості | |
| Молекулярна формула | KNO3 |
| Молярна маса | 101,1032 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 2,109 г/см³ (16 °C) |
| Тпл | 334 °C |
| Ткип | 400 °C (розкл.) |
| Розчинність (вода) | 133 г/л (0 °C) 360 г/Л (25 °C) 2470 г/Л (100 °C) |
| Структура | |
| Кристалічна структура | орторомбічна |
| Небезпеки | |
| ЛД50 | 3750 мг/кг |
| MSDS | ICSC 0184 |
| Індекс ЄС | Not listed |
| Класифікація ЄС | |
| NFPA 704 |
 0
1
0
OX
|
| Температура спалаху | Не займистий |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Безбарвні ромбічні або тригональні кристали, густина дорівнює 2,109 г/см³. Розчинний у воді й мало розчинний у спирті й етері. Молярна електропровідність при нескінечному розведенні при 25 °C дорівнює 144,96 См·см²/моль.
Хімічні властивості
При нагріванні виявляє окиснювальні властивості. Є активним реактивом, при температурі вище 400 ° С розкладається на нітрит калію і кисень, тому в лабораторіях використовують для отримання кисню:
Також використовують для отримання манганатів:
Мінерали
У природі утворює мінерал острівної будови групи арагоніту, який називають калійною (або індійською) селітрою.
Склад: 4[KNO3]. Містить: K2О — 46,5 %; N2O5 — 53,5 %, як правило, без домішок.
Сингонія ромбічна.
Блиск скляний. Прозорий. Колір білий. Злам напівраковистий до нерівного. Крихкий.
При температурі 339 °C переходить у тригональну ромбоедричну модифікацію.
Утворюється внаслідок розкладу органічних залишків під дією нітрифікуючих бактерій.
Розповсюджений в аридних областях разом із натрієвою селітрою, епсомітом, нітрокальцитом та гіпсом у пустелях на півночі Чилі, в Капській провінції ПАР, у районі Кочабамба (Болівія), у ґрунтах Долини Смерті (шт. Каліфорнія, США) та ін. Трапляється у вигляді тонких кірочок, дрібних голчастих кристалів, іноді — агрегатів.
Отримання в лабораторії
Отримують взаємодією азотної кислоти з металічним калієм, оксидом, гідроксид або карбонатом калію:
Використання
- З давніх-давен використовувався в піротехніці, зокрема, як основний компонент чорного пороху
- В основному використовується як добриво.
- Також використовують як окислювач
- Основний компонент у пожежних системах
- Ефективний інгібітор корозії.
- Консервант у харчовій промисловості (у виробництві сирів та м'ясних продуктів).
- Використовується в деяких зубних пастах
Див. також
Джерела
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966 . — Т. 1. — 1072 с.
- Неорганическая химия. / Под ред. Третьякова Ю. Д.. — М.: Изд. центр «Академия», 2004 . — Т. 2. — 368 с. — ISBN 5-7695-1436-1
- Глінка М. Л. Загальна хімія : підручник. — 2-ге вид., перероб. і доп. — Київ : Вища школа, 1982. — 608 с.