Гемоглобін
Гемоглобін (від грец. αἷμα, трансліт. haîma — кров і лат. globus — куля + -ін), скорочено Hb або Hgb — залізовмісний киснево-транспортний металопротеїн в еритроцитах (червоних кров'яних тільцях) більшості хребетних[1] (за винятком родини риб Білокрівкові[2]) та тканинах деяких безхребетних. Гемоглобін у крові переносить кисень від легень або зябер до решти тіла (тобто тканин). Там він вивільняє кисень, щоби забезпечити аеробне дихання, яке своєю чергою забезпечує енергію задля виконання функцій орагінзму в процесі, який має назву обмін речовин. У здоровому ораганізмі на 100 мл крові міститься від 12 до 20 грам гемоглобіну.
| Гемоглобін | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (гетеротетрамер, (αβ)2) | |||||||||||||
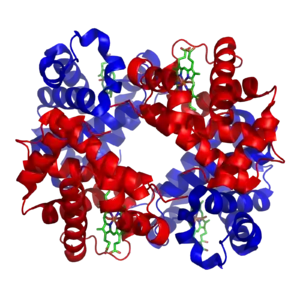 Структура гемоглобіну людини. α і β субодиниці мають червоний і синій колір відповідно, а залізовмісні гемові групи - зелений. Взято з PDB 1GZX Протеопедія Hemoglobin | |||||||||||||
| Тип білка | металопротеїн, глобулін | ||||||||||||
| Функція | транспорт кисню | ||||||||||||
| Кофактори | гем (4) | ||||||||||||
| |||||||||||||
У ссавців білок становить близько 96 % сухого вмісту еритроцитів (за вагою) і близько 35 % загального їх вмісту (враховуючи воду)[3]. Гемоглобін має здатність прив'язати до себе 1.34 мл O2 на грам речовини[4], що збільшує загальну ємність кисню в крові у 70 разів, порівнюючи з просто розчиненим у крові киснем. Молекула гемоглобіну ссавців може прив'язати (перенести) до 4 молекул кисню[5].
Гемоглобін також залучений до транспорту інших газів: він переносить частину вуглекислого газу (близько 20–25 % загальної кількості[6]) у вигляді карбогемоглобіна, у якому CO2 прив'язується до гемопротеїна. Молекула також переносить важливу регуляторну молекулу оксид азоту(II) (NO), зв'язану з тіоловою групою білка глобіну, вивільняючи його одночасно з киснем[7].
Гемоглобін також був знайдений за межами еритроцитів і їх прогеніторних ліній. Серед інших клітин, які містять гемоглобін, є дофамінергічні нейрони A9 у чорній речовині, макрофаги, клітини альвеол, легені, пігментний епітелій сітківки, гепатоцити, клітини ниркового мезангія, клітини ендометрія, клітини шийки матки і вагінальні епітеліальні клітини[8]. У цих тканинах гемоглобін виконує не киснево-транспортну функцію, а функції антиоксиданта і регулятора метаболізму заліза[9]. Надмірний вміст глюкози в крові може приєднатися до гемоглобіну і підвищити рівень гемоглобіну A1c[10].
Гемоглобін і гемоглобіноподібні молекули також наявні в багатьох безхребетних, грибів і рослин[11]. У цих організмів гемоглобін може переносити кисень або транспортувати та регулювати інші малі молекули та іони, такі як вуглекислий газ, оксид азоту, сірководень та сульфід. Варіант молекули, який називається легоглобін, використовується для видалення кисню з анаеробних систем, таких як азот-фіксуючі клубні бобових рослин, щоб кисень не отруїв (деактивував) систему.
Гемоглобінемія — це медичний стан, при якому спостерігається надлишок гемоглобіну в плазмі крові. Це є ефектом внутрішньосудинного гемолізу, при якому гемоглобін відділяється від еритроцитів, форма анемії.
Історія досліджень

1825 року Йоган Фрідріх Енгельгарт виявив, що співвідношення заліза до білка однакове в гемоглобінах кількох видів[13][14]. З відомої атомної маси заліза він обчислив молекулярну масу гемоглобіну до n × 16000 (n = кількість атомів заліза в молекулі гемоглобіну (зараз відомо, що їх 4)), перше визначення молекулярної маси білка. Цей «поспішний висновок» викликав багато насмішок у вчених, які не могли повірити, що якась молекула може бути настільки великою. Гілберт Смітсон Адер підтвердив результати Енгельгарта 1925 року вимірюванням осмотичного тиску розчинів гемоглобіну[15].
Хоча про те, що кров переносить кисень, було відомо ще з 1794 року[16][17], властивість гемоглобіну переносити кисень була описана Гюнфельдом 1840 року[18]. 1851 року німецький фізіолог Отто Функе опублікував серію статей, у яких він описав вирощування кристалів гемоглобіну шляхом послідовного розведення еритроцитів таким розчинником, як чиста вода, спирт або ефір, з наступним повільним випаровуванням розчинника з отриманого розчину білка[19][20]. Кілька років потому було описано оборотну оксигенацію (оксигенація гемоглобіну — приєднення кисню до заліза в гемі) гемоглобіну Феліксом Гоппе-Зейлером[21].
1959 року Макс Фердинанд Перуц визначив молекулярну структуру гемоглобіну за допомогою рентгеноструктурного аналізу[22][23]. Ця робота призвела до того, що він, разом із Джоном Кендрю, 1962 року отримав Нобелівську премія з хімії за дослідження структури глобулярних білків.
Роль гемоглобіну в крові була з'ясована французьким фізіологом Клодом Бернаром. Назва гемоглобін пішла від слів гем і глобін, відображаючи той факт, що кожна субодиниця гемоглобіну є глобулярним білком зі вбудованою гемовою групою. Кожна гемова група містить один атом заліза, який може прив'язати одну молекулу кисню за допомогою дипольних сил, спричинених іонами. Найбільш поширений тип гемоглобіну у ссавців містить 4 таких субодиниці.
Генетика
Гемоглобін складається з білкових субодиниць (молекул глобінів) і ці білки у свою чергу є складеними ланцюжками з великої кількості різноманітних амінокислот, тому їх називають поліпептиди. Амінокислотна послідовність будь-якого поліпептиду, створеного клітиною, у свою чергу визначається ділянками ДНК, які називаються генами. У всіх білках саме амінокислотна послідовність визначає хімічні властивості та функцію білка.
Генів гемоглобіну існує декілька: у людей гемоглобін A (основна форма гемоглобіну в дорослих) кодується генами HBA1, HBA2 та HBB[24]. Субодиниці гемоглобіну альфа-1 і альфа-2 кодуються генами HBA1 і HBA2 відповідно, які обидва розташовані на хромосомі 16 близько один до одного. Субодиниця гемоглобіну бета кодується геном HBB, розташованим на хромосомі 11. Амінокислотні послідовності білків глобіну в гемоглобінах зазвичай різняться між видами. Ці відмінності зростають з еволюційною відстанню між видами. Наприклад, найпоширеніші послідовності гемоглобіну у людей, бонобо і шимпанзе повністю ідентичні, навіть без жодної відмінної амінокислоти в ланцюгах білка альфа або бета глобіну[25][26][27]. У той час як гемоглобін людини і горили відрізняються однією амінокислотою як в альфа-, так і в бета-ланцюгах, ці відмінності збільшуються між менш спорідненими видами.
Навіть усередині виду існують різні варіанти гемоглобіну, хоча одна послідовність зазвичай є «найбільш поширеною» в кожному виді. мутації в генах білка гемоглобіну призводять до появи варіантів гемоглобіну всередині видів[28][29]. Більшість із цих мутантних форм гемоглобіну не викликають захворювань. Однак, деякі з них викликають групу спадкових захворювань гемоглобінопатію. Найбільш відомою гемоглобінопатією є серпоподібноклітинна анемія, яка стала першою людською хворобою, чий механізм було досліджено і зрозуміло на молекулярному рівні. Більшість видів таласемії виникають через недостатнью кількість виробленого нормального, а іноді й анормального, гемоглобіну, через проблеми або мутації в регуляції експресії генів глобінів. Усі ці захворювання призводять до анемії[30].

Варіації в послідовностях амінокислот гемоглобіну, як і інших білків, можуть бути викликаними адаптаціями організму. Наприклад, було виявлено, що гемоглобін по-різному адаптується до великих висот. Організми, що живуть на великих висотах, відчувають нижчий парціальний тиск кисню в порівнянні з організмами що живуть на рівні моря. Це є проблемою для організмів, які населяють таке середовище, оскільки гемоглобін, який зазвичай зв'язується з киснем при високому парціальному тиску, повинен бути здатним зв'язуватися з киснем при нижчому. Різні організми пристосувалися до цього виклику. Наприклад, нещодавні дослідження показали генетичні відмінності в білоногих хом'ячків, які допомагають пояснити, як вони, живучи в горах, здатні виживати в тамтешньому розрідженому повітрі. Дослідник із Університету Небраски-Лінкольна знайшов мутації в 4 різних генах, що може пояснити відмінності між білоногими хом'ячками, які живуть у низинних преріях, тими, які живуть у горах. Після дослідження диких мишей, виловлених як у високогірних, так і в низинних районах, було виявлено, що гени двох груп «практично ідентичні — за винятком тих, які визначають здатність їхнього гемоглобіну переносити кисень». «Генетична різниця дозволяє високогірним мишам більш ефективно використовувати свій кисень», оскільки його менше доступно на більших висотах, наприклад у горах[31]. Гемоглобін мамонтів мав мутації, які забезпечували доставку кисню за низьких температур, що дозволяло їм мігрувати до вищих широт у плейстоценовій епосі[32]. Схожі мутації також було виявлено у колібрі, які населяють Анди. Колібрі витрачають багато енергії і, отже, мають високу потребу в кисні, але було виявлено, що колібрі в Андах поширені на великих висотах. Несинонімічні мутації в гені гемоглобіну багатьох видів, що живуть на значних висотах (Oreotrochilus, A. castelnaudii, C. violifer, P. gigas і A. viridicuada) призвели до того, що білок має меншу спорідненість із інозитолгексафосфатом (IHP), молекулою, знайденою у птахів, яка виконує подібну роль, як 2,3-BPG у людей; це призводить до здатності зв'язуватися з киснем при нижчих парціальних тисках[33].
Пташині унікальні кровоносні легені також підвищують ефективність використання кисню при низьких парціальних тисках O2. Ці дві адаптації підсилюють одна одну і пояснюють чудову продуктивність птахів на великій висоті.
Адаптації в гемоглобіні наявні й у людей. У тибетських жінок, які живуть на висоті 4000 м над рівнем моря, із генотипом, який підвищує сатурацію, спостерігається вищий рівень виживання потомства[34]. Природний відбір, здається, є основною силою, що діє на цей ген, оскільки рівень смертності нащадків значно нижчий у жінок із вищою спорідненістю гемоглобіну та кисню в порівнянні з рівнем смертності потомства в жінок із низькою такою спорідненістю. Хоча точний генотип і механізм, за допомогою якого це відбувається, ще не ясні, відбір впливає на здатність гемоглобіну цих жінок зв'язуватися з киснем при низькому парціальному тиску, що в цілому дозволяє їм краще підтримувати важливі метаболічні процеси.
Синтез
Синтезу гемоглобіну (Hb) передує складна серія кроків. Гемова частина синтезується в мітохондріях і цитозолях незрілих еритроцитів, тоді як білові частини глобіни синтезуються рибосомами в цитозолі[35]. Вироблення гемоглобіну продовжується у клітині протягом усього її раннього розвитку від проеритробласту до ретикулоцита в кістковому мозку. У цей момент у ссавців клітинне ядро еритроцитів втрачається, але не у птахів і багатьох інших видів. Навіть після втрати ядра у ссавців, залишкова рибосомна РНК дозволяє подальший синтез гемоглобіну, допоки ретикулоцит не втратить свої РНК незадовго після потрапляння до судин (ця гемоглобін-синтетична РНК насправді надає ретикулоциту його сітчастий вигляд і, відповідно, назву, яка походить від англ. reticulated — сітчастий)[36].
Структура гему
Гемоглобін має четвертинну структуру, характерну для багатьох глобулярних білків, що містять багато субодиниць[37]. Більшість амінокислот у кладі гемоглобіну утворюють альфа-спіралі і ці спіралі з'єднані короткими неспіральними сегментами. Водневі зв'язки стабілізують спіральні ділянки всередині цього білка, викликаючи тяжіння всередині молекули, що потім змушує кожен поліпептидний ланцюг згортатися в певну форму[38]. Четвертинна структура гемоглобіну походить від його чотирьох субодиниць, які мають приблизно тетраедричну структуру[37].
У більшості хребетних молекула гемоглобіну складається із чотриьох субодиниць — глобулярних білків. Кожна субодиниця складається з білкового ланцюга, тісно з'єднаного з небілковою простетичною гемовою групою. Кожен білковий ланцюг складається з множини альфа-спіральних структурних сегментів, з'єднаних разом у глобін. Таку назву було дано тому, що така організація має той самий принцип згортання, як і в інших білків гем/глобін, таких як міоглобін[39][40]. У результаті такого згортання утворюється кишеня, до якої міцно прив'язується гемова група.
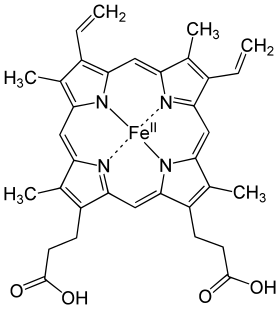
Гемова група складається з іона заліза (Fe), розташованого в гетероциклічному кільці, відомого як порфірин. Це порфіринове кільце складається з чотирьох молекул піролу циклічно з'єднаних разом (метиновими містками) з іоном заліза, зв'язаним у центрі[41]. Іон заліза, який є місцем прив'язування кисню, з'єднаний із чотирма атомами азоту в центрі кільця, які всі знаходяться в одній площині. Гем міцно (ковалентно) з'єднаний із глобулярним білком за допомогою атомів азоту (N) кільця імідазолу залишку F8 гістидину (також відомого як проксимальний гістидин) під порфіриновим кільцем. Шоста позиція може оборотно прив'язувати кисень за допомогою донорно-акцепторного зв'язку[42], завершуючи октаедричну групу з шести лігандів. Це оборотне зв'язування з киснем є причиною такої користі гемоглобіну в транспортуванні кисню по тілу[43]. Один атом кисню зв'язується з Fe, а інший виступає і утворює кут. Коли кисень не прив'язаний, дуже слабко зв'язана молекула води заповнює вільне місце, утворюючи спотворений октаедр.
Незважаючи на те, що вуглекислий газ переноситься гемоглобіном, він не конкурує з киснем за позиції, що зв'язують залізо, а зв'язується з амінними групами білкових ланцюгів, приєднаних до гемових груп.
Стан атома заліза може бути або Fe2+, або Fe3+, але феррігемоглобін (метгемоглобін) (Fe3+) не здатен приєднувати кисень[44]. При зв'язуванні кисень тимчасово і оборотно виступає в ролі окисника (Fe2+) на (Fe3+), при цьому тимчасово перетворюючись на іон супероксиду. Таким чином, для зв'язування кисню залізо повинне мати ступінь окиснення +2. Якщо іон супероксиду, приєднаний до Fe3+, протоноується, залізо в гемоглобіні залишиться окисненим і нездатним приєднати кисень. У таких випадках фермент метгемоглобінредуктази зможе в кінцевому підсумку реактивувати метгемоглобін відновивши атом заліза.
У дорослих людей найбільш поширеним типом гемоглобіну є тетрамер (який містить 4 білкових субодиниці), який називається гемоглобін A, який складається з двох α- і двох β-субодиниць, з'єднаних нековалентно, кожен із яких складається зі 141 і 146 амінокислотних залишків відповідно. Це позначається як α2β2. Субодиниці є структурно схожими та мають приблизно однаковий розмір. Кожна субодиниця має молекулярну масу приблизно 16,000 а. о. м.[45], при цьому загальна молекулярна маса всього тетрамеру становить 64,000 а. о. м. (64 458 г/моль)[46]. Так, 1 г/дл (грам на децилітр) = 0.1551 ммоль/літр (мілімоль на літр). Гемоглобін A є найбільш вивченою з молекул гемоглобіну.
У дітей грудного віку молекула гемоглобіну складається з двох α-ланцюгів і двох γ-ланцюгів. γ-ланцюги поступово замінюються β-ланцюгами у міру зростання дитини[47].
4 поліпептидних ланцюги з'єднані між собою сольовими містками, водневими зв'язками і гідрофобною взаємодією.
Насичення киснем
Загалом, гемоглобін може бути насичений молекулами кисню (оксигемоглобін) або ненасичений (дезоксигемоглобін)[48].
Оксигемоглобін
Оксигемоглобін утворюється під час фізіологічного дихання, коли кисень зв'язується з гемовою частинкою білка гемоглобіну в еритроцитах. Цей процес відбувається в легеневих капілярах, що прилягають до легеневих альфеол. Кисень переміщується через кров'яний потік, щоб потрапити до клітин, де він використовується як кінцевий акцептор електронів у виробництві АТФ процесом окисного фосфорилювання. Однак це не допомагає протидіяти зниженню pH крові. Дихання може змінити таке становище виведенням вуглекислого газу, таким чином спричинаючи зсув у pH[49].
Гемоглобін існує в двох формах: «натягнутій (напруженій) формі» (T) і «розслабленій формі» (R). Багато факторів, такі як низький pH, високий рівень CO2 і 2,3-бісфосфогліцеринової кислоти (2,3-BPG) у тканинах, сприяють натягнутій формі, яка має низьку спорідненість із киснем та вивільняє його у тканинах. І навпаки, високий pH, низький рівень CO2 або 2,3 BPG у тканинах сприяє розслабленій формі, яка може краще приєднувати кисень[50]. Парціальний тиск системи також впливає на спорідненість із O2. Великий парціальний тиск кисню (як, наприклад, в альвеолах) сприяє розслабленому (висока спорідненість, R) стану. І навпаки, низький парціальний тиск (як, наприклад, у тканинах, яким потрібний кисень), сприяє натягнутому (низька спорідненість, T) стану[51]. Крім того, зв'язування кисню з гемом із атомом заліза Fe2+ тягне залізо в площину порфіринового кільця, викликаючи невеликий конформаційний зсув. Зсув спонукає кисень зв'язуватися з трьома гемовими одиницями, що залишилися в гемоглобіні (таким чином, зв'язування кисню є кооперативним).
Дезоксигемоглобін
Дезоксигемоглобін — форма гемоглобіну без приєднаного кисню. Абсорбційні спектри оксигемоглобіну і дезоксигемоглобіну відрізняються. Оксигемоглобін має значно нижче поглинання при довжині хвилі 660 нм, тоді як при 940 нм його поглинання трохи вище. Ця різниця використовується для вимірювання кількості кисню в крові пацієнта інструментом, який називається пульсоксиметр. Ця різниця також пояснює прояви ціанозу — синьо-фіолетовий колір, якого набувають клітини при гіпоксії[52].
Дезоксигемоглобін є парамагнетиком; він слабо притягується магнітними полями[53][54]. Натомість оксигемоглобін проявляє діамагнетизм, слабке відштовхування від магнітного поля[54].
Фізіологічна роль
Гемоглобін є одним з основних білків, якими харчуються плазмодії малярії, і в ендемічних щодо малярії районах земної кулі вельми поширені спадкові аномалії будови гемоглобіну, що ускладнюють малярійним плазмодіям живлення цим білком і проникнення до еритроцитів. Зокрема, до таких аномалій, що мають еволюційно-пристосовне значення, відноситься серпоподібноклітинна анемія. Проте, на жаль, ці аномалії, як і аномалії будови гемоглобіну, що не мають явно пристосовного значення, супроводжуються порушенням функції транспорту кисню гемоглобіном, зниженням стійкості еритроцитів до руйнування, анемією та іншими негативними наслідками. Аномалії будови гемоглобіну називаються гемоглобінопатіями.
Гемоглобін високо токсичний при попаданні значної його кількості з еритроцитів в плазму крові (що відбувається при масивному внутрішньосудинному гемолізі, геморагічному шоці, гемолітичних анеміях, переливанні несумісної крові та інших патологічних станах). Токсичність гемоглобіну, що знаходиться поза еритроцитами, у вільному стані в плазмі крові, виявляється тканинною гіпоксією — погіршенням кисневого постачання тканин, перевантаженням організму продуктами руйнування гемоглобіну — залізом, білірубіном, порфіринами з розвитком жовтяниці або гострою порфірії, закупоркою ниркових канальців великими молекулами гемоглобіну з розвитком некрозу ниркових канальців і гострої ниркової недостатності.
Зважаючи на гаптоглобін, що специфічно зв'язує вільний глобін і глобін у складі гемоглобіну. Комплекс гаптоглобіну і глобіну (або гемоглобіну) потім захоплюється селезінкою і макрофагами тканинної ретікуло-ендотеліальної системи і знешкоджується.
Іншою частиною гемоглобінознешкоджуючої системи є білок гемопексин, що специфічно зв'язує вільний гем і гем у складі гемоглобіну. Комплекс гему (або гемоглобіну) і гемопексину потім захоплюється печінкою, гем відщеплюється і використовується для синтезу білірубіну та інших жовчних пігментів, або випускається в рециркуляцію в комплексі з трансферином для повторного використання кістковим мозком в процесі еритропоезу.
Хвороби, пов'язані з гемоглобіном
Гемоглобінова недостатність може бути викликана або зниженням кількості молекул гемоглобіну, як при анемії, або через зниження здатності кожної молекули приєднувати кисень при однаковому кисневому парціальному тиску. Гемоглобінопатії (генетичні дефекти, що призводять до анормальної структури молекули гемоглобіну[55]) може викликати обидві ситуації. У будь-якому випадку гемоглобінова недостатність знижує здатність крові транспортувати кисень. Гемоглобінову недостатність, як правило, строго відрізняють від гіпоксемії, яка викликана зниженням парціального тиску кисня в крові[56][57][58][59], хоча обидві є причинами гіпоксії (недостатнє постачання тканин киснем).
Інші поширеніі причини низького рівня гемоглобіну включають втрату крові, дефіцит поживних речовин, проблеми з кістковим мозком, хімієтерапію, ниркова недостатність або анормальний гемоглобін (такий, як при серпоподібноклітинній анемії).
Здатність кожної молекули гемоглобіну переносити кисень зазвичай модифікується зміненою pH крові або CO2, спричинаючи зміну кривої дисоціації кисню і гемоглобіну. Однак вона також може бути змінена патологічно, як, наприклад, при отруєнні чадним газом.
Зниження рівня гемоглобіну, з або без абсолютного зниження рівня еритроцитів, призводить до симптомів анемії. В анемії є багато різних причин, хоча ферропатія (дефіцит заліза) і як результат залізодефіцитна анемія є найбільш поширеними причинами в Західному світі. Оскільки відсутність заліза знижує синтез гемів, еритроцити при залізодефіцитній анемії є гіпохромними (без червоного пігменту гемоглобіну) і мікроцитарні (менші ніж нормальні). Інші види анемії є рідкісними. При гемолізі (пришвидшене розпаді еритроцитів), жовтяниця спричиняється метаболітом гемоглобіну білірубіном і циркулюючий гемоглобін може спричинити ниркову недостатність.
Деякі мутації в глобіновому ланцюгу пов'язані з гемоглобінопатіями, такими як серпоподібноклітинна анемія і таласемія. Інші мутації, вказані на початку статті, є доброякісними і розглядаються лише як варіанти гемоглобіну.
Існує група генетичних розладів, відомих як порфірії, які характеризуються помилками в метаболічних шляхах синтезу гемів. Король Георг III був, мабуть, найвідомішим хворим на порфірію.
У невеликих кількостях гемоглобін A повільно приєднує глюкозу до кінця валіну (альфа-амінокислота) у кожному β-ланцюзі. Отриману молекулу часто називають Hb A1c, глікований гемоглобін. Приєднання глюкози до амінокислот у гемоглобіні відбувається спонтанно (без допомоги ферментів) і, як відомо, не слугує для корисних цілей. Однак, зі збільшенням зростання концентрації глюкози в крові, відсоток гемоглобіну A, який перетворюється на гемоглобін A1c зростає. У діабетиків, у яких рівень глюкози зазвичай високий, відсоток гемоглобіну A1c також високий. Через те, що приєднання глюкози в гемоглобіні A відбувається дуже повільно, відсоток гемоглобіну A1c показує середнє значення рівня глюкози в крові протягом часу життя еритроцитів, що становить 120 діб[60]. Таким чином, рівень глікованого гемоглобіну вимірюють для моніторингу хронічного захворювання цукрового діабету 2 типу. Поганий контроль діабету 2 типу призводить до високого рівня глікованого гемоглобіну в еритроцитах. Діапазон нормальних значень становить приблизно 4,0–5,9 %. Хоча їх важко отримати, значення менше 7 % рекомендовані для людей із діабетом 2 типу. Рівні понад 9 % пов'язані з поганим контролем глікованого гемоглобіну, а рівні понад 12 % пов'язані з дуже поганим контролем. Діабетики, які підтримують рівень глікованого гемоглобіну на рівні близько 7 %, мають набагато більше шансів уникнути ускладнень, які можуть супроводжувати цукровий діабет (ніж ті, у яких рівень 8 % або вище)[61]. Крім того, підвищений глікований гемоглобін збільшує його спорідненість із киснем, таким чином запобігаючи його вивільненню в тканинах і в крайніх випадках викликаючи гіпоксію[62].
Підвищений рівень гемоглобіну пов'язаний зі збільшенням кількості або розмірів еритроцитів (поліцитемія). Підвищення може бути спричинене вродженою хворобою серця, легеневим серцем, пневмосклерозом, зависоким рівнем еритропоетину або справжньою поліцитемією[63]. Високий рівень гемоглобіну також може бути викликаний перебуванням на великій висоті, курінням, зневодненням (штучно підвищуючи концентрацію гемоглобіну), прогресуючими захворюваннями легенів та деякими пухлинами[47].
Нещодавнє дослідження, проведене в Пудучеррі, Індія, показує значення гемоглобіну при ішемічній хворобі серця[64].
Див. також
- Карбогемоглобін (гемоглобін пов'язаний із CO2)
- Карбоксигемоглобін (гемоглобін пов'язаний із CO)
- Хлорофіл (гем із магнієм)
- Клінічний аналіз крові
- Дельта-глобін
- Гемоглобінометр
- Гемопротеїн
- Метгемоглобін (феррігемоглобін)
- Оксигемоглобін (із двоатомним киснем, забарвлений у криваво-синій колір)
- Tegillarca granosa
Примітки
- Maton, Anthea; Jean Hopkins; Charles William McLaughlin; Susan Johnson; Maryanna Quon Warner; David LaHart; Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey, US: Prentice Hall. ISBN 978-0-13-981176-0.
- Sidell, Bruce; Kristin O'Brien (2006). When bad things happen to good fish: the loss of hemoglobin and myoglobin expression in Antarctic icefishes. The Journal of Experimental Biology 209 (Pt 10): 1791–802. PMID 16651546. doi:10.1242/jeb.02091.
- Weed, Robert I.; Reed, Claude F.; Berg, George (1963). Is hemoglobin an essential structural component of human erythrocyte membranes?. J Clin Invest 42 (4): 581–88. PMC 289318. PMID 13999462. doi:10.1172/JCI104747.
- Dominguez de Villota ED, Ruiz Carmona MT, Rubio JJ, de Andrés S (1981). Equality of the in vivo and in vitro oxygen-binding capacity of hemoglobin in patients with severe respiratory disease. Br J Anaesth 53 (12): 1325–28. PMID 7317251. doi:10.1093/bja/53.12.1325.
- Costanzo, Linda S. (2007). Physiology. Hagerstwon, MD: Lippincott Williams & Wilkins. ISBN 978-0-7817-7311-9.
- Patton, Kevin T. (10 лютого 2015). Anatomy and Physiology. Elsevier Health Sciences. ISBN 978-0-323-31687-3. Архів оригіналу за 26 квітня 2016. Процитовано 1 лютого 2022.
- Epstein, F. H.; Hsia, C. C. W. (1998). Respiratory Function of Hemoglobin. New England Journal of Medicine 338 (4): 239–47. PMID 9435331. doi:10.1056/NEJM199801223380407.
- Saha D, Reddy KV, etal (2014). Hemoglobin Expression in Nonerythroid Cells: Novel or Ubiquitous?. Int J Inflamm 2014 (803237): 1–8. PMC 4241286. PMID 25431740. doi:10.1155/2014/803237.
- Biagioli M, Pinto M, Cesselli D, etal (2009). Unexpected expression of alpha- and beta-globin in mesencephalic dopaminergic neurons and glial cells. Proc. Natl. Acad. Sci. 106 (36): 15454–59. Bibcode:2009PNAS..10615454B. PMC 2732704. PMID 19717439. doi:10.1073/pnas.0813216106.
- Blood Tests. National Heart, Lung, and Blood Institute (NHLBI). Архів оригіналу за 9 квітня 2019. Процитовано 1 лютого 2022.
- Weber RE, Vinogradov SN (2001). Nonvertebrate hemoglobins: functions and molecular adaptations. Physiol. Rev. 81 (2): 569–628. PMID 11274340. doi:10.1152/physrev.2001.81.2.569.
- «Max Perutz, Father of Molecular Biology, Dies at 87 Архівовано 2016-04-23 у Wayback Machine.». The New York Times. February 8, 2002
- Engelhart, Johann Friedrich (1825). Commentatio de vera materia sanguini purpureum colorem impertientis natura (лат.). Göttingen: Dietrich.
- Engelhard & Rose on the Colouring Matter of the Blood. Edinburgh Medical and Surgical Journal 27 (90): 95–102. 1827. PMC 5763191. PMID 30330061.
- Adair, Gilbert Smithson (1925). A critical study of the direct method of measuring the osmotic pressure of hǣmoglobin. Proc. R. Soc. Lond. A 108 (750): 292–300. Bibcode:1925RSPSA.109..292A. doi:10.1098/rspa.1925.0126.
- Parry, CH (1794). Letters from Dr. Withering, ... Dr. Ewart, ... Dr. Thorton ... and Dr. Biggs ... together with some other papers, supplementary to two publications on asthma, consumption, fever, and other diseases, by T. Beddoes (англ.). Google Books. с. 43.
- Beddoes, T (1796). Considerations on the Medicinal Use, and on the Production of Factitious Airs: Part I. By Thomas Beddoes, M.D. Part II. By James Watt, Engineer; "Part 1, section 2, "Of the breathing of man and familiar animals" (англ.). Bulgin and Rosser. с. Part 1, p. 9–13.
- Hünefeld, Friedrich Ludwig (1840). Der Chemismus in der thierischen Organisation (нім.). Leipzig: F. A. Brockhaus. Процитовано 1 лютого 2022.
- Funke O (1851). Über das milzvenenblut. Z Rat Med 1: 172–218.
- A NASA Recipe For Protein Crystallography. Educational Brief. National Aeronautics and Space Administration. Архів оригіналу за 10 квітня 2008. Процитовано 1 лютого 2022.
- Hoppe-Seyler F (1866). Über die oxydation in lebendem blute. Med-chem Untersuch Lab 1: 133–40.
- Perutz, M.F.; Rossmann, M.G.; Cullis, A.F.; Muirhead, H.; Will, G.; North, A.C.T. (1960). Structure of haemoglobin: a three-dimensional Fourier synthesis at 5.5-A. resolution, obtained by X-ray analysis. Nature 185 (4711): 416–22. Bibcode:1960Natur.185..416P. PMID 18990801. doi:10.1038/185416a0.
- Perutz MF (1960). Structure of haemoglobin. Brookhaven Symposia in Biology 13: 165–83. PMID 13734651.
- Hardison, Ross C. (1 грудня 2012). Evolution of hemoglobin and its genes. Cold Spring Harbor Perspectives in Medicine 2 (12): a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182. doi:10.1101/cshperspect.a011627.
- Offner, Susan (1 квітня 2010). Using the NCBI Genome Databases to Compare the Genes for Human & Chimpanzee Beta Hemoglobin. The American Biology Teacher (англ.) 72 (4): 252–56. ISSN 0002-7685. doi:10.1525/abt.2010.72.4.10.
- HBB – Hemoglobin subunit beta – Pan paniscus (Pygmy chimpanzee) – HBB gene & protein. www.uniprot.org. Процитовано 2 лютого 2022.
- HBA1 – Hemoglobin subunit alpha – Pan troglodytes (Chimpanzee) – HBA1 gene & protein. www.uniprot.org. Процитовано 2 лютого 2022.
- Huisman THJ (1996). A Syllabus of Human Hemoglobin Variants. Globin Gene Server. Pennsylvania State University. Архів оригіналу за 11 грудня 2008. Процитовано 3 лютого 2022.
- Hemoglobin Variants Архівовано 2006-11-05 у Wayback Machine.. Labtestsonline.org. Retrieved 2013-09-05.
- Uthman, MD, Ed. Hemoglobinopathies and Thalassemias. Архів оригіналу за 15 грудня 2007. Процитовано 3 лютого 2022.
- Reed, Leslie. «Adaptation found in mouse genes.» Omaha World-Herald, 11 Aug. 2009: EBSCO. [сторінка?]
- Mammoths had ′anti-freeze′ blood. BBC. 2 травня 2010. Архів оригіналу за 4 травня 2010. Процитовано 3 лютого 2022.
- Projecto-Garcia, Joana; Natarajan, Chandrasekhar; Moriyama, Hideaki; Weber, Roy E.; Fago, Angela; Cheviron, Zachary A.; Dudley, Robert; McGuire, Jimmy A. та ін. (17 грудня 2013). Repeated elevational transitions in hemoglobin function during the evolution of Andean hummingbirds. Proceedings of the National Academy of Sciences 110 (51): 20669–74. Bibcode:2013PNAS..11020669P. ISSN 0027-8424. PMC 3870697. PMID 24297909. doi:10.1073/pnas.1315456110.
- Beall, Cynthia M.; Song, Kijoung; Elston, Robert C.; Goldstein, Melvyn C. (28 вересня 2004). Higher offspring survival among Tibetan women with high oxygen saturation genotypes residing at 4,000 m. Proceedings of the National Academy of Sciences of the United States of America 101 (39): 14300–04. Bibcode:2004PNAS..10114300B. ISSN 0027-8424. PMC 521103. PMID 15353580. doi:10.1073/pnas.0405949101.
- Hemoglobin Synthesis. 14 квітня 2002. Архів оригіналу за 26 грудня 2007. Процитовано 2 лютого 2022.
- Burka, Edward (1969). Characteristics of RNA degradation in the erythroid cell. The Journal of Clinical Investigation 48 (7): 1266–72. PMC 322349. PMID 5794250. doi:10.1172/jci106092. Архів оригіналу за 9 серпня 2018. Процитовано 2 лютого 2022.
- Van Kessel, Hans (2002). Proteins – Natural Polyamides. Nelson Chemistry 12. Toronto: Thomson. с. 122. ISBN 978-0-17-625986-0.
- «Hemoglobin Tutorial.» Архівовано 2009-11-26 у Wayback Machine. University of Massachusetts Amherst. Web. 23 Oct. 2009.
- Steinberg, MH (2001). Disorders of Hemoglobin: Genetics, Pathophysiology, and Clinical Management. Cambridge University Press. с. 95. ISBN 978-0-521-63266-9. Архів оригіналу за 17 листопада 2016. Процитовано 3 лютого 2022.
- Hardison, RC (1996). A brief history of hemoglobins: plant, animal, protist, and bacteria. Proc Natl Acad Sci USA 93 (12): 5675–79. Bibcode:1996PNAS...93.5675H. PMC 39118. PMID 8650150. doi:10.1073/pnas.93.12.5675.
- «Hemoglobin.» Архівовано 2009-11-13 у Wayback Machine. School of Chemistry — Bristol University — UK. Web. 12 Oct. 2009.
- WikiPremed > Coordination Chemistry Архівовано 2009-08-23 у Wayback Machine.. Retrieved July 2, 2009
- Basic Biology (2015). Blood cells.
- Linberg R, Conover CD, Shum KL, Shorr RG (1998). Hemoglobin based oxygen carriers: how much methemoglobin is too much?. Artif Cells Blood Substit Immobil Biotechnol 26 (2): 133–48. PMID 9564432. doi:10.3109/10731199809119772.
- Hemoglobin Архівовано 2017-03-15 у Wayback Machine.. Worthington-biochem.com. Retrieved 2013-09-05.
- Van Beekvelt MC, Colier WN, Wevers RA, Van Engelen BG (2001). Performance of near-infrared spectroscopy in measuring local O2 consumption and blood flow in skeletal muscle. J Appl Physiol 90 (2): 511–19. PMID 11160049. doi:10.1152/jappl.2001.90.2.511.
- «Hemoglobin.» Архівовано 2012-01-24 у Wayback Machine. MedicineNet. Web. 12 Oct. 2009.
- «Hemoglobin Home.» Архівовано 2009-12-01 у Wayback Machine. Biology @ Davidson. Web. 12 Oct. 2009.
- Hemoglobin saturation graph. altitude.org. Архів оригіналу за 31 серпня 2010. Процитовано 3 лютого 2022.
- King, Michael W. The Medical Biochemistry Page – Hemoglobin. Архів оригіналу за 4 березня 2012. Процитовано 3 лютого 2022.
- Voet, D. (2008) Fundamentals of Biochemistry, 3rd. ed., Fig. 07_06, John Wiley & Sons. ISBN 0470129301
- Ahrens; Kimberley, Basham (1993). Essentials of Oxygenation: Implication for Clinical Practice. Jones & Bartlett Learning. с. 194. ISBN 978-0-86720-332-5.
- Ogawa, S; Menon, R. S.; Tank, D. W.; Kim, S. G.; Merkle, H; Ellermann, J. M.; Ugurbil, K (1993). Functional brain mapping by blood oxygenation level-dependent contrast magnetic resonance imaging. A comparison of signal characteristics with a biophysical model. Biophysical Journal 64 (3): 803–12. Bibcode:1993BpJ....64..803O. PMC 1262394. PMID 8386018. doi:10.1016/S0006-3495(93)81441-3.
- Bren KL, Eisenberg R, Gray HB (2015). Discovery of the magnetic behavior of hemoglobin: A beginning of bioinorganic chemistry. Proc Natl Acad Sci U S A 112 (43): 13123–27. Bibcode:2015PNAS..11213123B. PMC 4629386. PMID 26508205. doi:10.1073/pnas.1515704112.
- "hemoglobinopathy" на вебсайті Dorland's Medical Dictionary
- hypoxemia Архівовано 2009-02-02 у Wayback Machine.. Encyclopædia Britannica, stating hypoxemia (reduced oxygen tension in the blood).
- Biology-Online.org --> Dictionary " H " Hypoxemia Архівовано 2009-11-21 у Wayback Machine. last modified 29 December 2008
- William, C. Wilson; Grande, Christopher M.; Hoyt, David B. (2007). Pathophysiology of acute respiratory failure. Trauma, Volume II: Critical Care. Taylor & Francis. с. 430. ISBN 978-1-4200-1684-0. Архів оригіналу за 17 листопада 2016. Процитовано 6 лютого 2022.
- McGaffigan, P. A. (1996). Hazards of hypoxemia: How to protect your patient from low oxygen levels. Nursing 26 (5): 41–46; quiz 46. PMID 8710285. doi:10.1097/00152193-199626050-00013.
- NGSP: HbA1c and eAG. www.ngsp.org. Архів оригіналу за 15 жовтня 2015. Процитовано 6 лютого 2022.
- «Definition of Glycosylated Hemoglobin.» Архівовано 2014-01-23 у Wayback Machine. Medicine Net. Web. 12 Oct. 2009.
- Madsen, H; Ditzel, J (1984). Blood-oxygen transport in first trimester of diabetic pregnancy. Acta Obstetricia et Gynecologica Scandinavica 63 (4): 317–20. PMID 6741458. doi:10.3109/00016348409155523.
- Hemoglobin Архівовано 2016-06-10 у Wayback Machine. at Medline Plus
- Padmanaban, P.; Toora, B. (2011). Hemoglobin: Emerging marker in stable coronary artery disease. Chronicles of Young Scientists 2 (2): 109. doi:10.4103/2229-5186.82971.
Література
- Campbell, MK (1999). Biochemistry (вид. третє). Harcourt. ISBN 978-0-03-024426-1.
- Eshaghian, S; Horwich, TB; Fonarow, GC (2006). An unexpected inverse relationship between HbA1c levels and mortality in patients with diabetes and advanced systolic heart failure. Am Heart J 151 (1): 91.e1–91.e6. PMID 16368297. doi:10.1016/j.ahj.2005.10.008.
- Ganong, WF (2003). Review of Medical Physiology (вид. 21-ше). Lange. ISBN 978-0-07-140236-1.
- Hager, T (1995). Force of Nature: The Life of Linus Pauling. Simon and Schuster. ISBN 978-0-684-80909-0.
- Kneipp J, Balakrishnan G, Chen R, Shen TJ, Sahu SC, Ho NT, Giovannelli JL, Simplaceanu V, Ho C, Spiro T (2005). Dynamics of allostery in hemoglobin: roles of the penultimate tyrosine H bonds. J Mol Biol 356 (2): 335–53. PMID 16368110. doi:10.1016/j.jmb.2005.11.006.
Hardison, Ross C. (2012). Evolution of Hemoglobin and Its Genes. Cold Spring Harbor Perspectives in Medicine 2 (12): a011627. ISSN 2157-1422. PMC 3543078. PMID 23209182. doi:10.1101/cshperspect.a011627.
Посилання
- Протеопедія Hemoglobin
- National Anemia Action Council — anemia.org
- Новий тип гемоглобіну «знущається» з діагнозів за допомогою пульсоксиметра
- Анімація гемоглобіну: від дезокси- до оксиформи
Пов'язані запитання: