Пентахлорид фосфору
Пентахлорид Фосфору, ще відомий як Хлорид Фосфору (V) — високореакційна хімічна сполука з формулою PCl5, що застосовується як хлоруючий реагент в хімічному синтезі. Це біла (безбарвна) кристалічна сполука, що розпливається на повітрі внаслідок гідролізу.
| Хлорид Фосфору (V) | |
|---|---|
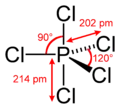 Структура молекули пентахлориду фосфору в газовій фазі | |
 |
 |
 Ампула з пентахлоридом фосфору | |
| Назва за IUPAC | Пентахлорид фосфору Хлорид Фосфору (V) |
| Ідентифікатори | |
| Номер CAS | 10026-13-8 |
| PubChem | 24819 |
| Номер EINECS | 233-060-3 |
| ChEBI | 30335 |
| RTECS | TB6125000 |
| SMILES |
ClP(Cl)(Cl)(Cl)Cl |
| InChI |
1/Cl5P/c1-6(2,3,4)5 |
| Номер Гмеліна | 2622 |
| Властивості | |
| Молекулярна формула | Cl5P |
| Молярна маса | 208,24 г/моль |
| Зовнішній вигляд | безбарвні (білі) кристали, що розпливаються на повітрі |
| Запах | кислий запах продуктів гідролізу |
| Густина | 2.1 г/см3 |
| Тпл | 160.5 °C |
| Розчинність (вода) | бурхливо реагує |
| Розчинність | розчинний в CS2, хлороформі, бензені взаємодіє зі спиртами, етил ацетатом |
| Тиск насиченої пари | 1.11 кПа (80 °C) 4.58 кПа (100 °C) |
| Структура | |
| Кристалічна структура | тетрагональна |
| Координаційна геометрія |
D3h (тригональна біпіраміда) |
| Дипольний момент | 0 D |
| Термохімія | |
| Ст. ентропія S |
364.2 Дж/моль·K |
| Теплоємність, c |
111.5 Дж/моль·K |
| Небезпеки | |
| ГДК (США) | TWA 1 мг/м3 |
| ЛД50 | 660 мг/кг(щурі, перорально) |
| ГГС піктограми |    [1] [1] |
| ГГС формулювання небезпек | 302, 314, 330, 373 |
| ГГС запобіжних заходів | 260, 280, 284, 305+351+338, 310 |
| NFPA 704 |
 0
3
2
|
| Температура спалаху | Не горючий |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Структура
В газоподіібному стані і аполярних розчинниках пентахлорид фосфору має молекулярну будову[2]. Молекула PCl5 — тригональна біпіраміда (симетрія D3h), що відповідає найбільшому віддаленню між п'ятьма атомами хлору зв'язаними з центральним атомом фосфору і повністю узгоджується з теорією відштовхування електронних пар валентних оболонок. В твердому ж стані пентахлорид фосфору має іонниу будову. Його кристали сформовані з тетраєдричних катіонів PCl+4 та октаєдричних аніонів PCl−6.[3] В полярних розчинниках сполука дисоціює по на ці ж йони
- 2 PCl5
 [PCl+4][PCl6−]
[PCl+4][PCl6−]
а при сильнішому розведенні — з утворенняв вільного хлорид-аніону[4]
- PCl5
 [PCl+4]Cl−
[PCl+4]Cl−
Отриманння
PCl5 отримують хлоруваннням PCl3.[5] Річне світове виробництво пентахлориду фосфору становить близько 10 тис. тон.[3]
- PCl3 + Cl2
 PCl5 (ΔH = −124 кДж/моль)
PCl5 (ΔH = −124 кДж/моль)
Хімічні властивості
Атом Фосфору в PCl5 збіднений електронами і виступає як сильний електрофільний центр. Завдяки цьому пентахлорид фосфору активно реагує з практично будь-якими нуклеофілами вступаючи в реакції заміщення атомів хлору, чи приєднання основ Льюїса до атома фосфору.
Реакції заміщення
Пентахлорид фосфору бурхливо взаємодіє з водою з утворення ортофосфорної кислоти та хлороводню.
- PCl5 + 4 H2O → H3PO4 + 5 HCl
При недостачі води реакція зупиняється на стадії оксихлориду фосфору:
- PCl5 + H2O → POCl3 + 2 HCl
Зі спиртами реакція може протікати з утворенням різних продуктів в залежності від структури спирту та співвідношення реагентів. Часто відбувається перетворення аліфатичних спиртів на алкілхлориди:
- PCl5 + 2ROH → POCl3 + RCl + HCl
Аналогічно відбувається перетворення карбонових кислот на хлорангідриди[6]:
- PCl5 + 2RCOOH → POCl3 + RCOCl + HCl
Висока стабільність оксихлориду фосфору зумовлює також реакції PCl5 з багатьма неорганічними оксидами та кислотами:
Пентахлорид фосфору також здатен заміщувати на атоми хлору оксиген амідних груп утворюючи так звані реактиви Вільсмаєра та деяких кетонних груп утворюючи дихлориди:
- PCl5 + Me2N-CH=O → POCl3 + [Me2N=CHCl]+[POCl4]-
- PCl5 + Ph2C=O → POCl3 + Ph2CCl2
Окисно-відновні реакції
Ступінь окислення +5 для фосфору є найстабільнішою, тому PCl5 рідко виступає у ролі відновника чи окисника. Сильне нагрівання PCl5 може призводити до відщеплення молекули хлору
- PCl5 → PCl3 + Cl2
Також при нагріванні можливе окисне хлоруванння й інших сполук.
- PCl5 + 2NO2 → PCl3 + 2NO2Cl
Реакції Приєднання
Пентахлорид фосфору здатен виступати як кислота Льюїса та приєднувати сполуки, що мають вільну електронну пару з утворенням сполук гексакоординованого фосфору. Прикладом таких реакцій є взаємодія з піридином:
- PCl5 + C5H5N → C5H5NPCl5
Бідентатні ліганди здатні заміщувати частину атомів хлору, утворюючи похідні, аналогічні комплексам металів[7].
- PCl5 + bipy → [(bipy)PCl4]+Cl-
Посилання
- Phosphorus pentachloride
- D. E. C. Corbridge (1995). Phosphorus: an outline of its chemistry, biochemistry, and uses. Elsevier Science Ltd. ISBN 0-444-89307-5.
- Arnold F. Holleman; Egon Wiber; Nils Wiberg (2001). Inorganic Chemistry. Academic Press. ISBN 978-0-12-352651-9.
- Suter, R. W.; Knachel, H. C.; Petro, V. P.; Howatson, J. H.; S. G. Shore, S. G. (1978). Nature of Phosphorus(V) Chloride in Ionizing and Nonionizing Solvents. J. Am. Chem. Soc. 95 (5): 1474–1479. doi:10.1021/ja00786a021.
- R. N. Maxson,"Phosphorus Pentachloride" Inorganic Syntheses 1939, vol. 1, pp. 99–100. DOI:10.1002/9780470132326.ch34
- Adams, R.; Jenkins, R. L. (1941). p-Nitrobenzoyl chloride. Org. Synth.; Coll. Vol. 1: 394.
- Bezgubenko, L. V.; Pipko,S. E.; Sinitsa, A. D. (2011). Complexes of Phosphorus Halides with Two or More Coordination Bonds. Russ. J. Gen. Chem. 81 (8): 1596–1614. doi:10.1134/S1070363211080056.