Хлороформ
Хлорофо́рм (англ. Chloroform) — прозора, безбарвна, важча за воду летка рідина з характерним солодким запахом.
| Структурна формула | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
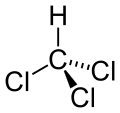  | |||||||||||||||||||||||||
| Загальна інформація | |||||||||||||||||||||||||
| Преференційна назва ІЮПАК | Хлороформ | ||||||||||||||||||||||||
| Систематична назва ІЮПАК | Трихлорометан | ||||||||||||||||||||||||
| Інші назви |
| ||||||||||||||||||||||||
| Хімічна формула | CHCl3 | ||||||||||||||||||||||||
| 3D Структура (JSmol) | Інтерактивне зображення | ||||||||||||||||||||||||
| Зовнішні ідентифікатори / Бази даних | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Властивості | |||||||||||||||||||||||||
| Молярна маса | 119.38 г·моль−1 | ||||||||||||||||||||||||
| Агрегатний стан |
Рідина | ||||||||||||||||||||||||
| Густина |
1.48 г·см-3 (20 °C)[1] | ||||||||||||||||||||||||
| Температура плавлення |
-63 °C[1] | ||||||||||||||||||||||||
| Температура кипіння |
61 °C[1] | ||||||||||||||||||||||||
| Тиск насиченої пари |
209 гПа (20 °C)[1] | ||||||||||||||||||||||||
| Розчинність |
8 г·дм-3 (H2O, 20 °C)[1] | ||||||||||||||||||||||||
| Дипольний момент | |||||||||||||||||||||||||
| Термодинамічні властивості | |||||||||||||||||||||||||
| ΔfH⦵298 |
-134.1 кДж·моль-1 | ||||||||||||||||||||||||
| Безпека | |||||||||||||||||||||||||
| Маркування згідно системі УГС
Небезпека | |||||||||||||||||||||||||
| H-фрази | H: H302, H331, H315, H319, H351, H361d, H336, H372 | ||||||||||||||||||||||||
| P-фрази | P: P261, P281, P305+P351+P338, P311 | ||||||||||||||||||||||||
| LD50 |
| ||||||||||||||||||||||||
| LC50 |
47.7 мг/дм3/4 год (інгалятивно, пацюк)) | ||||||||||||||||||||||||
| Наскільки це можливо, значення величин подані в одиницях системи SI. Якщо не вказано іншого, усі дані відносяться до стандартного стану. | |||||||||||||||||||||||||
Історія
-3.jpg.webp)
Хлороформ уперше отримали в 1831 році американець Сем'юелем Гатрі,[3] німець Юстусом Лібігом[4] та французом Ейженом Субейраном незалежно один від одного. Оскільки Гатрі був першим, хто описав цю сполуку, він фактично вважаєтьтся її відкривачем. Фізичні й хімічні властивості хлороформу, а також його молекулярну формулу («C4H2Ch6»[5] або C2H2Cl6[6]) вперше описав Жан-Батист Дюма в 1834 році. Саме Дюма дав цій сполуці, що Лібіг назвав «хлорованим вуглецем» назву «хлороформ».[7] У 1842 р. британський лікар Роберт Мортімер Гловер, а в 1847 р. французький фізіолог Марі Жан П'єр Флоренс і шотландський лікар й акушер Джеймс Янг Сімпсон[8] за результатами експерименту над тваринами визнали наркозні властивості хлороформу. А вже через рік, завдяки Сімпсону, хлороформ використовувався поруч із етером при полегшенні пологових болів. Друг Сімпсона, хірург і хімік Девід Уолді,[9] ймовірно, був першим, хто запропонував застосування хлороформу для хірургічної анестезії.
До речі, акушерську хлороформну анестезію критикувала англіканська церква. Багато священнослужителів вважали, що пологовий біль – справедливе покарання за гріх Єви, тобто Божа воля.[10] Великим проривом було застосування хлороформу до королеви Вікторії (тобто, голови англіканської церкви), коли вона народжувала свою восьму дитину. Нарешті, у 1853 році анестезія «à la reine» («королевська») стала найпоширенішою анестезією в Європі. Лише у 1890 р. через небажані побічні ефекти із частими смертельними наслідками хлороформної анестезії.[11]
Отримання
Вперше хлороформ було отримано дією хлорного вапна на ацетон у присутності сірчаної кислоти:
Сучасний промисловий метод отримання хлороформу полягає у поступовому хлоруванні метану при 400—500 °С:[12]
ΔrG = − 106.9 кДж/моль
ΔrG = − 102.2 кДж/моль
ΔrG = − 96.4 кДж/моль
ΔrG = − 78.7 кДж/моль
Отримані продукти розділяються шляхом дистиляції.
У лабораторії хлороформ можна отримати за допомогою галоформної реакції (взаємодією ацетона з гіпохлоритом натрію, хлороформ збирається знизу):[13]
Хлороформ також утворюється при декарбоксилюванні трихлороцтової кислоти, яке проходить при її нагріванні з лугами або амінами[14]:
Властивості
Фізичні властивості
Хлороформ — безбарвна, негорюча, летка рідина з солодкуватим запахом. Він має більшу густину, ніж вода, ці дві рідини лише слабко змішуються. З підвищенням температури розчинність хлороформу у воді зменшується; у той же час розчинність води в хлороформі збільшується.[15]
| Розчинності хлороформу й води один в одному | ||||||||||
| Температура / °C) | 0 | 9,5 | 19,6 | 29,5 | 39,3 | 49,2 | 59,2 | |||
| Хлороформ у воді (масова частка / %) | 1,02 | 0,93 | 0,82 | 0,79 | 0,74 | 0,77 | 0,79 | |||
| Вода у хлороформі (масова частка / %) | 0,0365 | 0,0527 | 0,0661 | 0,0841 | 0,1108 | 0,1353 | 0,1672 | |||
Хлороформ утворює азеотропні суміші з рядом розчинників. Склад азеотропів та їхні температури кипіння можна знайти в таблиці:[16]
| Азеотропи з різними розчинниками | |||||||||||
| Розчинник | вода | метанол | етанол | 2-пропанол | ацетон | 2-бутанон | діізопропіловий
етер |
тетрагідрофуран | метилацетат | етилацетат | н-гексан |
| Вміст хлороформу / % | 97 | 87 | 93 | 96 | 78 | 17 | 36 | 66 | 77 | 28 | 83 |
| Температура кипіння / °С | 56 | 53 | 59 | 61 | 64 | 80 | 71 | 73 | 78 | 78 | 60 |
Хімічні властивості
В присутності лугів хлороформ утворює дихлорокарбени, які згодом можуть буди використані в реакціях циклопропанування. Реакція Фріделя-Крафтса між хлороформом і бензеном утворює трифенілметан.
У присутності кисню і світла хлороформ розпадаєтьтся, утворюючи фосген, хлор і хлорид водню. Тому комерційний хлороформ містить 0,5–1,0 % етанолу в якості стабілізатора, щоб нейтралізувати випадкові сліди фосгену. Інша небажана реакція хлороформу може протікати в присутності ацетону: ці дви речовини в результаті дуже бурхливої реакції утворюють 1,1,1-трихлоро-2-метил-2-пропанол (α,α,α-трихлоро-трет-бутанол).:
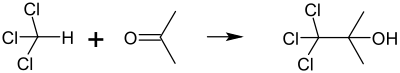
Можливість цієї реакції є однією з причин, чому відходи хлорованих й нехлорованих розчинників слід збирати в окремі контейнери.[17]
Використання
Хлороформ чудово розчиняє багато органічних матеріалів, але внаслідок його високої токсичності перевага все більлше віддається дихлорометану. Промислове споживання хлороформу (до 90 %) наразі іде на виробництво монохлородіфлюорометану (фреон 22).
Дейтерохлороформ (CDCl3) один з найбільш вживаних розчинників для спектроскопії ядерного магнітного резонансу.
Токсичність
Рвотні позови, запаморочення, мігрень, втома — перші ознаки отруєння хлороформом. При подальшому впливі на організм, хлороформ викликає хвороби печінки і нирок, а у вагітних жінок можливі викидні. Негативно впливає на нервову систему. При вдиханні у великій кількості можлива зупинка дихання.
Хлороформ підозрюється в канцерогенності.
Дейтерохлороформ

Дейтерований хлороформ (емпірична формула: CDCl3, CAS-№: 865-49-6), який також називають дейтерохлороформом, використовується як розчинник в ядерній магнітно-резонансній спектроскопії (ЯМР); він є найдешевшим із дейтерованих розчинників,[18] що зумовило його широке використання. Синтез здійснюється шляхом взаємодії кальцієвої солі трихлорооцтової кислоти з важкою водою:[19]
На 1H ЯМР спектрі хлороформ-d дає синглет із хімічним зсувом δ 7.26 ppm; на 13С ЯМР можна побачити триплет на δ 77 ppm.[20]
Фізичні властивості хлороформу-d дещо відрізняються від недейтерованої сполуки:[21]
- Температура плавлення: −64 °C
- Температура кипіння: 60,9 °C
- Густина: 1.500 г/см3 (25 °С)
- Коефіцієнт заломлення: 1.444 (20 °C)
Див. також
Примітки
- Внесок про трихлорметан в базі даних GESTIS.
- David R. Lide (Ред.): CRC Handbook of Chemistry and Physics. 90th Edition.
- Хлороформ на сайті Notable Names Database (англ.)
- Justus Liebig: Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildndes Gas und Essiggeist entstehen // Annalen der Pharmacie. — 1832. — B. 1. — S. 182—230 (Хлороформ на «Google Books»).
- Jean-Baptiste-André Dumas: Recherches relatives à l'action du chlore sur l'alcool. In: L'Institut. Journal général des société et travaux scientifiques des la France et l’étranger. Band 2, (5. April) 1834, S. 106—108.
- Jean-Baptiste-André Dumas: Untersuchung über die Wirkung des Chlors auf den Alkohol. In: Annalen der Physik und Chemie. Neue Folge, Band 31, 1834, S. 650—673 (Оцифрований документ на сайті електронної бібліотеки Gallica).
- Albert Faulconer, Thomas Edward Keys: Chloroform. In: Foundations of Anesthesiology. 2 Bände, Charles C Thomas, Springfield (Illinois) 1965, Band 1, S. 442—481, hier: S. 442 f., 455—462.
- J. Y. Simpson: On a new anaesthetic agent, more efficient than sulphuric ether. In: Lancet. Band 2, (20. November) 1847, S. 549 f. (Хлороформ на «Google Books»).
- Ray J. Defalque, Amos J. Wright: The Discovery of Chloroform: Has David Waldie's Role Been Exaggerated? In: Anesthesiology. Band 114, Nr. 4, 2011, S. 1004—1005, doi:10.1097/ALN.0b013e31820ca94c.
- WDR1 — Stichtag 9. November 2007 — Vor 160 Jahren: Erste Entbindung mit Chloroform-Narkose. Abgerufen am 29. November 2017.
- Christoph Weißer: Chloroform. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin 2005, ISBN 3-11-015714-4, S. 257.
- Barbara Elvers, ред. (2019). Ullmann's encyclopedia of industrial chemistry (вид. Sixth edition). Weinheim, Germany: Wiley-WCH. ISBN 978-3-527-30673-2. OCLC 751968805.
- Chemgapedia: Synthese von Trichlormethan.
- XuMuK.ru - ХЛОРУКСУСНЫЕ КИСЛОТЫ - Химическая энциклопедия. xumuk.ru (російська).
- R. M. Stephenson: Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992), S. 80–95, doi:10.1021/je00005a024.
- I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 142–143.
- Lutz Roth, Ursula Weller Gefährliche Chemische Reaktionen ISBN 3-609-73090-0 ecomed Sicherheit; 2005
- Complete list | Eurisotop. www.eurisotop.com. Процитовано 5 січня 2020.
- Preparation of chloroform-d, auf prepchem.com.
- Fulmer, Gregory R.; Miller, Alexander J. M.; Sherden, Nathaniel H.; Gottlieb, Hugo E.; Nudelman, Abraham; Stoltz, Brian M.; Bercaw, John E.; Goldberg, Karen I. (10 травня 2010). NMR Chemical Shifts of Trace Impurities: Common Laboratory Solvents, Organics, and Gases in Deuterated Solvents Relevant to the Organometallic Chemist. Organometallics (англ.) 29 (9). с. 2176–2179. ISSN 0276-7333. doi:10.1021/om100106e. Процитовано 5 січня 2020.
- Chloroform-d. Sigma-Aldrich. Процитовано 5 січня 2020.

