Рівняння Гілла (біохімія)
Рівня́ння Гі́лла — наближення, що дозволяє кількісно описати процеси зв'язування ліганду з макромолекулою, якщо інша молекула того самого або іншого ліганду вже зв'язана з даної макромолекулою. Це рівняння названо на честь англійського фізіолога та біохіміка Арчибальда Гілла.
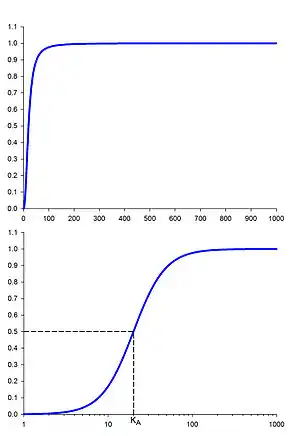
Рівняння описує частку макромолекул, насичених лігандом, як функцію від концентрації ліганду; воно в основному використовується для опису ступеню кооперативності зв'язування ліганду з ферментом або рецептором. Рівняння було вперше використане Арчібальдом Гіллом для опису сігмоїдної кривої зв'язування кисню з гемоглобіном[1].
Рівняння Гілла:
- , де
- — частка місць (сайтів) зв'язування де ліганд може зв'язатись з макромолекулою, які вже окуповані лігандом;
- — концентрація вільного (не зв'язаного з макромолекулами, або іншим реакційним субстратом) ліганду;
- — уявна константа дисоціації, що виводиться з закону діючих мас;
- — концентрація ліганду, що призводить до окупації половини наявних сайтів зв'язування (або викликає 50%-й ефект), яка числено дорівнює мікроскопічній константі дисоціації;
- — коефіцієнт Гілла, що визначає кооперативність реакції (але інколи і інші біохімічні властивості, залежно від контексту, в якому рівняння використовується).
Для згаданого вище випадку взаємодії кисню з гемоглобіном = 2,8—3.
Інша вживана форма запису рівняння Гілла є наступною:
У випадку ліганд-рецепторної взаємодії числове значення коефіцієнту Гілла визначає кооперативність ліганд-рецепторної взаємодії наступним чином:
- — Позитивна кооперативність: при зв'язуванні однієї молекули ліганда афінність рецептора до наступної молекули підвищується (тобто, наступна молекула зв'язується з більшою вірогідністю);
- — Негативна кооперативність: при зв'язуванні однієї молекули ліганда афінність рецептора до наступної молекули знижується;
- — Некооперативна реакція: афінність рецептора або субстрата до ліганда лишається незмінною незалежно від кількості молекул ліганда, вже зв'язаних з рецептором.
Рівняння Гілла в контексті кількісного опису взаємозв'язку між концентрацією реакційного субстрату (або кількістю наявних сайтів зв'язування) та часткою окупованих сайтів зв'язування є еквівалентом рівняння Ленгмюра.
Рівняння Гілла з математичної точки зору є логістичною функцією, а в деяких випадках — її логаріфмічною формою; таким чином, при побудові графіку рівняння Гілла на логаріфмічній шкалі цей графік виглядає ідентично логістичному. Це особливо важливо при нелінійній апроксимації експериментальних даних у випадках, коли ефект ліганду є сталим для його концентрацій, які відрізняються на декілька порядків. В цьому випадку для формальної апроксимації експериментальних даних можна (а іноді навіть варто) використовувати логістичну функцію.
Примітки
- Hill, A. V. (22 січня 1910). The possible effects of the aggregation of the molecules of hæmoglobin on its dissociation curves (PDF). J. Physiol. 40 (Suppl): iv–vii. Архів оригіналу за 1 грудня 2008. Процитовано 18 березня 2009.
Джерела
- Dorland's Illustrated Medical Dictionary
- Lehninger Principles of Biochemistry, 4th edition, David L. Nelson & Michael M. Cox
- Coval ML (December 1970). Analysis of Hill interaction coefficients and the invalidity of the Kwon and Brown equation. J. Biol. Chem. 245 (23): 6335–6. PMID 5484812. Процитовано 18 березня 2009.
- Biochemistry, Donald Voet and Judith G. Voet
- B. Mitavskiy, D. Chu, and Radu Zabet. (2009). Models of transcription factor binding: Sensitivity of activation functions to model assumptions.. Journal of Theoretical Biology 257 (3): 419–429.
