Спектральні серії водню
Спектральні серії водню — набір спектральних серій, що складають спектр атома водню. Оскільки водень — найпростіший атом, його спектральні серії вивчено найкраще. Вони добре підпорядковуються формулі Рідберґа:
- ,
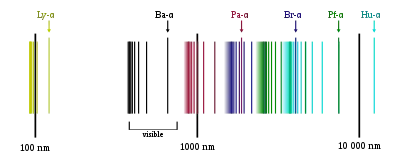
де R = 109 677 см−1 — стала Рідберґа для водню, n′ — основний рівень серії.
Спектральні лінії, що виникають при переходах на основний енергетичний рівень, називаються резонансними, всі інші — субординатними.
Фізика спектральних серій
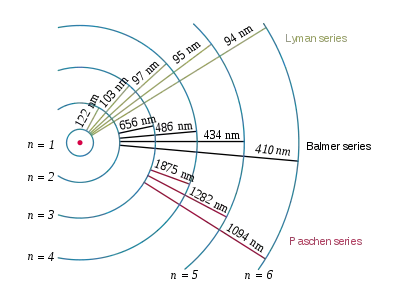
Атом водню складається з електрона, що обертається навколо ядра. Електромагнітна сила між електроном і протоном ядра викликає наявність набору квантових станів електрона, кожен з яких має свою енергію. Ці стани зображуються на борівський моделі як окремі орбіти електрона. Кожній орбіті або стану відповідає ціле число n.
Спектральне випромінювання відбувається, коли електрон переходить з вищого енергетичного стану в нижчий. Стан з нижчою енергією позначається як n′, а з вищою n. Енергія випроміненого фотона відповідає різниці енергій двох станів. Оскільки енергія кожного стану завжди однакова, різниця між ними теж завжди однакова і перехід завжди супроводжується випроміненням фотона зі сталою енергією.
Спектральні лінії згруповано в серії за n′. Лінії названо послідовно, починаючи від лінії з найнижчою частотою, грецькими літерами. Наприклад, лінія 2 → 1 називається лінією Лаймана-альфа (Ly-α), а 7 → 3 Пашена-дельта (Pa-δ).

У водню існують лінії, які не входять у ці серії, як, наприклад, 21 сантиметрова лінія. Ці лінії відповідають рідкіснішим процесам в атомі, таким як надтонкі переходи.[1] Тонка структура також виявляє єдині спектральні лінії, що мають вигляд двох і більше тісно згрупованих тонких ліній, утворених завдяки релятивістським ефектам.[2]
Серія Лаймана
Відкрив Теодор Лайман 1906 року. Всі лінії серії лежать в ультрафіолетовому діапазоні. Серія відповідає формулі Рідберґа за n′ = 1 і n = 2, 3, 4, …; лінія Lα = 1216 Å є резонансною лінією водню. Межа серії — 911,8 Å.
Серія Бальмера
Відкрив Йоганн Бальмер 1885 року. Перші чотири лінії серії лежать у видимому діапазоні і були відомі задовго до Бальмера, який запропонував емпіричну формулу для відповідних їм довжин хвиль і на її основі передбачив існування інших ліній цієї серії в ультрафіолетовій ділянці. Серія відповідає формулі Рідберґа за n′ = 2 і n = 3, 4, 5, …; лінія Hα = 6565 Å, межа серії — 3647 Å.
Серія Пашена
Передбачив Вальтер Рітц 1908 року на основі комбінаційного принципу. Відкрив Фрідріх Пашен того ж року. Всі лінії серії лежать в інфрачервоному діапазоні. Серія відповідає формулі Рідберґа за n′ = 3 і n = 4, 5, 6, …; лінія Pα = 18 756 Å, межа серії — 8206 Å.
Серія Брекета
Відкрив Фредерік Брекет 1922 року. Всі лінії серії лежать у близькому інфрачервоному діапазоні. Серія відповідає формулі Рідберґа за n′ = 4 і n = 5, 6, 7, …; лінія Bα = 40 522 Å. Межа серії — 14 588 Å.
Серія Пфунда
Відкрив Август Пфунд 1924 року. Лінії серії лежать у близькому (частина в середньому) інфрачервоному діапазоні. Серія відповідає формулі Рідберґа за n′ = 5 і n = 6, 7, 8, …; лінія Pfα = 74 598 Å. Межа серії — 22 794 Å.
Серія Гемпфрі
Відкрив Куртіс Гемпфрі 1953 року. Серія відповідає формулі Рідберґа за n′ = 6 і n = 7, 8, 9, …; основна лінія — 123 718 Åмежа серії — 32 823 Å.
Серія Гансена — Стронґа
Відкрили Джон Стронґ і Пітер Гансен 1972 року[3]. Серія відповідає формулі Рідберґа за n′ = 7 і n = 8, 9, 10, ….
Серії, раніше приписувані водню
Серія Фаулера
1912 року під час вивчення спектру випромінювання вакуумних трубок, заповнених сумішшю водню й гелію, Альфред Фаулер відкрив серію, що відповідала формулі Рідберґа для n′ = 1,5 і n = 2, 3, 4, …. Насправді ця серія належить одноразово йонізованому гелію для n′ = 3 і n = 4, 5, 6, ….
Серія Пікерінга
1896 року під час вивчення спектру зорі ζ Корми, Едвард Чарлз Пікерінг відкрив серію, що відповідає формулі Рідберґа для n′ = 2 і n = 2,5; 3,5; 4,5; …. Насправді ця серія належить одноразово йонізованому гелію для n′ = 4 і n = 5, 6, 7, ….
Див. також
Примітки
- The Hydrogen 21-cm Line. HyperPhysics. Університет штату Джорджія. 30 жовтня 2004. Процитовано 18 березня 2009.
- Liboff, Richard L.. Introductory Quantum Mechanics. — Addison–Wesley, 2002. — ISBN 0-8053-8714-5.
- Hansen, Peter; Strong, John (1973). Seventh Series of Atomic Hydrogen. Applied Optics 12 (2): 429–430. Bibcode:1973ApOpt..12..429H. doi:10.1364/AO.12.000429.