Сульфат барію
Сульфа́т ба́рію, ба́рій сульфа́т — неорганічна сполука, барієва сіль сульфатної кислоти складу BaSO4. Сіль є нерозчинною у воді, етанолі, розчинна у концентрованій сульфатній кислоті.
| Сульфат барію | |
|---|---|
 | |
 | |
| Назва за IUPAC | барій сульфат |
| Ідентифікатори | |
| Номер CAS | 7727-43-7 |
| Номер EINECS | 231-784-4 |
| DrugBank | 11150 |
| Назва MeSH | D01.103.075 і D01.875.800.800.850.075 |
| ChEBI | 133326 |
| RTECS | CR0600000 |
| SMILES |
[O-]S(=O)(=O)[O-].[Ba+2][1] |
| InChI |
InChI=1S/Ba.H2O4S/c;1-5(2,3)4/h;(H2,1,2,3,4)/q+2;/p-2 |
| Властивості | |
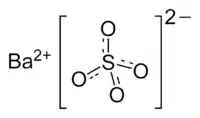
| Молекулярна формула | BaSO4 |
| Молярна маса | 233,391 г/моль |
| Зовнішній вигляд | білі кристали |
| Густина | 4,50 г/см³ |
| Тпл | 1580 °C |
| Розчинність (вода) | 0,00031 г/100 г (20 °C) 0,000285 г/100 г (30 °C) 0,00118 г/100 г (100 °C) |
| Розчинність (етанол) | нерозчинний |
| Показник заломлення (nD) | 1,64 |
| Структура | |
| Кристалічна структура | орторомбічна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-352,3 ккал/моль |
| Ст. ентропія S |
31,6 кал/(моль·K) |
| Теплоємність, c |
24,3 кал/(моль·K) |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Застосовується у виробництві білих пігментів, для охолодження та змащування бурових інструментів на нафтових свердловинах. Також використовується як протирадіаційна добавка в бетон та при рентгеноскопії стравоходу.
Поширення у природі
У земних надрах сульфат барію поширений у вигляді мінералу бариту BaSO4.
Фізичні властивості
Сульфат барію є білими ромбічними кристалами. Погано розчиняється у воді (добуток розчинності 1,08·10-10). Розчиняється у хлорній воді, бромідній та йодидній кислотах. Як розчинники сульфату барію також використовують нітрат цирконію, тіосульфат натрію, метафосфати і гідрокарбонати лужних металів.
Фосфоренціює в рентгенівських та катодних променях.
Отримання
Сульфат барію можна синтезувати дією сульфатної кислоти на солі барію. Продукт легко виділяється з розчину завдяки його малій розчинності:
Також застосовуються і реакції обміну, які включають варіації із використанням гідроксиду барію, сульфатів лужних металів
Також сульфат отримують прокалюванням сульфіду барію за температури 1000 °C:
Інші методи включають використання пероксиду барію, термічне розкладання сульфіту або тіосульфату барію:
Хімічні властивості
При нагріванні понад 1600 °C сульфат барію починає розкладатися:
Сполука не розчиняється у воді, не розчиняється і не реагує із багатьма кислотами. У концентрованій сульфатній кислоті BaSO4 утворює кислу сіль — гідросульфат барію:
Сульфат відновлюється коксом, воднем до сульфіду:
Токсичність
Сполуки барію є токсичними для людини, однак, на відміну від багатьох інших сполук, сульфат практично не розчинний у воді, а тому не має токсичної дії. На цьому і засновується дія антидоту при отруєннях солями барію — прийняти дозу сульфатів натрію або магнію для переведення барію у нерозчинний стан.
Застосування
Сульфат барію, осаджений спільно з сульфідом цинку, використовується як білий пігмент для захисного покриття — літопон. У суміші з сульфідом натрію він використовується як білий пігмент blanc fixe (фр. постійний білий).
Також BaSO4 використовується як буровий розчин для змащування й охолоджування бурового інструменту на нафтових свердловинах; він входить до складу укріплювача стінок свердловини для запобігання її обвалу.
Сульфат барію застосовується як наповнювач у фарбах, пластмасах та гумових виробах, як протирадіаційний компонент бетону, як флюс і добавки до скла, які збільшують показник заломлення. Він використовується як харчова добавка для збільшення непрозорості під час проведення рентгеноскопії органів травлення (так звана барієва каша).
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Dibello P. M., Manganaro J. L., Aguinaldo E. R., Mahmood T., Lindahl C. B. Barium Compounds // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 3. — P. 482. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Jager P., Riechers H. H., Wagner H., Winkler J., Wolf H. U. Barium and Barium Compounds // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 6-18. — DOI: (англ.)
- Рипан Р., Четяну И. Неорганическая химия: Химия металлов / Под ред. В. И. Спицына. — М. : «Мир», 1971. — Т. 1. — 561 с. (рос.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
