Тіосульфат натрію
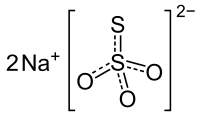
Ті́осульфа́т на́трію — неорганічна сполука, натрієва сіль тіосульфатної кислоти складу Na2S2O3. За звичайних умов перебуває у формі свого кристалогідрату Na2S2O3·5H2O, який є безбарвними кристалами; при невеликому нагріванні втрачає кристалізаційну воду. Тіосульфат проявляє сильні відновні властивості, здатен утворювати координаційні сполуки із металами.
| Тіосульфат натрію | |
|---|---|
 | |
 Пентагідрат тіосульфату натрію | |
| Назва за IUPAC | натрій тіосульфат[1] |
| Систематична назва | натрій сульфуротіоат[1] |
| Інші назви | гіпосульфіт натрію, антихлор (технічна назва) |
| Ідентифікатори | |
| Номер CAS | 7772-98-7 |
| Номер EINECS | 231-867-5 |
| ChEBI | 132112 |
| RTECS | XN6476000 |
| Код ATC | V03AB06 |
| SMILES |
[O-]S(=O)(=S)[O-].[Na+].[Na+][2] |
| InChI |
InChI=1S/2Na.H2O3S2/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
| Номер Бельштейна | 11323704 |
| Властивості | |
| Молекулярна формула | Na2S2O3 |
| Молярна маса | 158,110 г/моль |
| Зовнішній вигляд | білий порошок (безводний) безбарвні кристали (пентагідрат) |
| Густина | 2,267 г/см³ (безводний) 1,749 г/см³ (пентагідрат) |
| Тпл | 100 °C (розкл.) |
| Розчинність (вода) | 76,4 г/100 г |
| Небезпеки | |
| ЛД50 | 7,5 г/кг (миші) |
| Пов'язані речовини | |
| Інші аніони | сульфіт натрію, сульфат натрію, сульфід натрію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Напівлетальна доза тіосульфату натрію складає 7,5±0,752 г/кг тіла (для мишей).[3] Завдяки своїй низькій токсичності, тіосульфат може вільно використовуватися у медичніх цілях — він є антидотом при отруєннях ціанідами і сполуками срібла.
Тіосульфат натрію застосовується у фотографії для розчинення броміду срібла, у целюлозно-паперовій і текстильній галузях — для нейтралізації залишків хлору. Тіосульфат є реагентом для визначення вмісту йоду, брому, хлору та сірки за методом йодометрії. В харчовій промисловості тіосульфат натрію застосовується як антиоксидант та секвестрант; у міжнародному реєстрі харчових добавок він має код E539.[4]
Фізичні властивості
Чистий тіосульфат натрію є білим, важким порошком, проте за звичайних умов він перебуває у формі свого пентагідрату Na2S2O3·5H2O, який кристалізується з розчинів у вигляді коротких призматичних або довгастих кристалів. На сухому повітрі, при 33 °C, він втрачає вологу, а при 48 °C тіосульфат розчиняється у власній кристалізаційній воді.
| 0 °C | 10 °C | 20 °C | 25 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 33,1 | 36,3 | 40,6 | 43,3 | 45,9 | 52,0 | 62,3 | 65,7 | 68,8 | 69,4 | 70,1 | 71,0 |
Отримання
У промисловості тіосульфат натрію синтезують окисненням сульфіду, гідросульфіду або полісульфідів натрію. Окрім того, одним із поширених способів є взаємодія сірки із сульфітом натрію:
Додавання сірки до суспензії сульфіту проводять при постійному перемішуванні. Внесення катіонних поверхнево-активних речовин збільшує змочування сірки і, відповідно, швидкість реакції. Вихід реакції залежить від температури, кількості сірки та інтенсивності перемішування. Розчини тіосульфату натрію фільтрують гарячими, попередньо позбувшись надлишку сірки, і при охолодженні з них кристалізується гідрат Na2S2O3·5H2O, який дегідратують при температурі 60—105 °C за атмосферного або зниженого тиску. Чистота продукту складає близько 99% та має незначні домішки сульфіту і сульфату натрію.
Іншими промисловими способами є обробка сполук натрію діоксидом сірки:
Тіосульфат натрію також синтезується як побічний продукт у виробництві сірчаних барвників, де полісульфіди натрію окиснюються нітросполуками:
Хімічні властивості
Перебуваючи за звичайних умов у формі кристалогідрату, тіосульфат втрачає воду при слабкому нагріванні:
Подальше нагрівання спричиняє розкладання речовини: із утворенням сірки або пентасульфіду натрію (із домішками інших полісульфідів):
У затемненому місці розчин тіосульфату може зберігатися протягом кількох місяців, але при кип'ятінні він одразу розкладається.
Тіосульфат є нестійким до дії кислот:
Він є сильним відновником:
При взаємодії із галогенами тіосульфат відновлює їх до галогенідів:
Остання реакція знайшла застосування в аналітичній хімії у титриметричному методі йодометрія.
Тіосульфат бере участь у реакціях комплексоутворення, зв'язуючи сполуки деяких металів, наприклад, срібла:
Застосування
Тіосульфат натрію широко застосовується у фотографічній справі для розчинення броміду срібла з негативів чи відбитків. У целюлозно-паперовій і текстильній галузях тіосульфат застосовується для нейтралізації залишків хлору; він бере участь у дехлоруванні води.
У гірництві Na2S2O3 виконує роль екстрагента срібла з його руд. Тіосульфат є реагентом для визначення вмісту йоду, брому, хлору та сірки за методом йодометрії. Також тіосульфат є антидотом при отруєннях ціанідами і сполуками срібла.
Примітки
- Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005. — Cambridge : RSC Publishing, 2005. — P. 139. — ISBN 0-85404-438-8. (англ.)
- SODIUM THIOSULFATE
- Bean, S. L. Thiosulfates // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 24. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Class names and the international numbering system for food additives. fao.org. Food and Agriculture Organization of the United Nations. Процитовано 21 травня 2015.[недоступне посилання з червня 2019] (англ.)
- Розчинність визначається як відношення маси розчиненої речовини до маси утвореного розчину.
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
Джерела
- CRC Handbook of Chemistry and Physics / Lide, D. R., editor. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Bean, S. L. Thiosulfates // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 24. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Metzger, A. Sulfites, Thiosulfates, and Dithionites // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 4—5. — DOI: (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
