Сульфат натрію
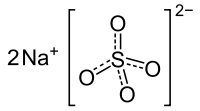
Сульфа́т на́трію, на́трій сульфа́т — неорганічна сполука, натрієва сіль сульфатної кислоти складу Na2SO4.
| Сульфат натрію | |
|---|---|
 | |
 | |
| Назва за IUPAC | Натрій сульфат |
| Ідентифікатори | |
| Номер CAS | 7757-82-6 |
| Номер EINECS | 231-820-9 |
| DrugBank | 09472 |
| KEGG | C13199 і D01732 |
| ChEBI | 32149 |
| RTECS | WE1650000 |
| Код ATC | A12CA02 |
| SMILES |
[O-]S(=O)(=O)[O-].[Na+].[Na+][1] |
| InChI |
InChI=1S/2Na.H2O4S/c;;1-5(2,3)4/h;;(H2,1,2,3,4)/q2*+1;/p-2 |
| Властивості | |
| Молекулярна формула | Na2SO4 |
| Молярна маса | 142,044 г/моль |
| Зовнішній вигляд | білі кристали або порошок |
| Густина | 2,664 г/см³ |
| Тпл | 884 °C[2] |
| Розчинність (вода) | 28,1 г/100 г |
| Розчинність (етанол) | нерозчинний |
| Показник заломлення (nD) | 1,468 |
| Структура | |
| Кристалічна структура | орторомбічна |
| Термохімія | |
| Ст. ентальпія утворення ΔfH |
-331,5 ккал/моль |
| Ст. ентропія S |
35,76 кал/(моль·K) |
| Теплоємність, c |
30,64 кал/(моль·K) |
| Пов'язані речовини | |
| Інші аніони | гідросульфат натрію, хлорид натрію |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Сульфат натрію широко застосовується для виробництва паперу за сульфатним методом, у виробництві соди, а також у скляній промисловості.
Поширення у природі

Безводний сульфат натрію розповсюджений у земних надрах як мінерал тенардит, інколи із високим ступенем чистоти. Іншим поширеним джерелом даної солі є її кристалогідрат Na2SO4·10H2O, котрим є мінерал мірабіліт (глауберова сіль). Значні поклади мірабіліту знайдені у в затоці Кара-Богаз-Гол (Туркменістан).
Сульфат натрію утворює тверді розчини з іншими сульфатами, а також карбонатами і хлоридами. До таких мінералів відносяться:
- астраханіт Na2SO4·MgSO4·4H2O;
- глазерит Na2SO4·3K2SO4;
- глауберит Na2SO4·CaSO4;
- вантгоффіт MgSO4·3Na2SO4;
- левеїт 6Na2SO4·7MgSO4·15H2O;
- дансит MgSO4·9Na2SO4·3NaCl;
- буркеїт Na2CO3·2Na2SO4;
- генксит KCl·2Na2CO3·9Na2SO4.
Сульфат натрію також може бути знайдений і у морській воді. Так, вода із середньою солоністю у 35‰ містить близько 4,063 г/л сульфату натрію.
Світові запаси сульфату натрію оцінюються у 3,4 млрд. тонн.
Фізичні властивості
Сульфат натрію є кристалами або порошкоподібною речовиною білого кольору. Він є гігроскопічним: вбираючи вологу та утворюючи декагідрат Na2SO4·10H2O, він суттєво збільшується у розмірах (до 4,17 разів). В охолоджених насичених розчинах також може існувати нестійкий гідрат Na2SO4·7H2O.
Речовина є добре розчинною у воді і малорозчинною в органічних розчинниках.
| 20 °C | 25 °C | 30 °C | 40 °C | 50 °C | 60 °C | 70 °C | 80 °C | 90 °C | 100 °C |
|---|---|---|---|---|---|---|---|---|---|
| 16,13 | 21,94 | 29,22 | 32,35 | 31,55 | 30,90 | 30,39 | 30,02 | 29,79 | 29,67 |
При нагріванні до температур, менших за 884 °C, розкладання солі практично не відбувається, а при температурах близько 1200 °C втрати складатимуть кілька відсотків.
Отримання
Промисловий сульфат натрію — нейтральна безводна натрієва сіль сірчаної кислоти (Na2SO4), яка задовольняє вимогам ГОСТ 6318-77 «Натрій сірчанокислий (сульфат натрію)»; виготовляється у вигляді порошкоподібного чи ґранульованого продукту і відпускається в розфасованому вигляді; зберігається в закритих складських приміщеннях, захищених від попадання вологи; постачається навалом і в мішках; застосовується як прискорювач тужавіння цементного розчину за температур вище 0°C.
Отримання з мінеральної сировини
Окрім переробки мінералів, що містять сульфат натрію безпосередньо, існують інші способи добування солі з природної сировини. Основними є методи синтезу зі складових, що містять у собі компененти натрію у сульфату. Так, за методом Маннгейма широко розповсюджений хлорид натрію оброблюють концентрованою (93-96%) сульфатною кислотою:
Дана реакція знайшла застосунок у схемі промислового виробництва соди (карбонату натрію). Чистота кінцевого продукту складає 97—99,7%. Залишкові кількості сульфатної ислоти, які можуть залишатися у продукті, нейтралізуються додаванням незначної кількості карбонату натрію. Окрім сульфату натрію, продуктом взаємодії є газуватий хлороводень, котрий також має прикладне значення.
За методом Гаргрівза сульфатну кислоту заміняє діоксид сірки при додатковому окисленні повітрям:
Як побічний продукт виробництв
У 1988 році світове виробництво Na2SO4 складало 4,6 млн. тонн, і майже половину цього складав сульфат натрію, отриманий як побічний продукт.
Виробництво віскози
Однією зі стадій в методі отримання віскозних волокон є взаємодія лужної солі целюлози із сірковуглецем, в результаті якої утворюється ксантогенат, котрий оброблюють сульфатною кислотою:
В результаті реакції утворюється близько одного кілограму сульфату натрію на кожен кілограм цільового волокна.
Виробництво дихроматів
Промислове добування дихроматів полягає у підкисленні розчину хромату натрію сульфатною кислотою:
Якщо взаємодія проводиться при температурах, вищих за 324 °C, з розчину кристалізується сульфат натрію із чистотою понад 99%. Така сіль може містити до 0,2% дихромату; для очищення її додатково розчиняють, відновлюють дихромат діоксидом сірки і відфільтровують нерозчинний оксид хрому(III).
Хімічні властивості
Сульфат натрію, утворений сильною основою і сильною кислотою, повністю дисоціює у воді (середовище нейтральне):
При розчиненні твердої солі у концентрованій сульфатній кислоті, утворюється кисла сіль — гідросульфат натрію:
Сполука здатна відновлюватися воднем і коксом:
Сіль окиснюється під дією вільного фтору:
Na2SO4 вступає в реакції обміну, які ведуть до утворення малорозчинних продуктів взаємодії:
Застосування
Сульфат натрію застосовується у виробництві паперу за сульфатним методом (крафт-процес), для синтезу соди. Також він використовується у виготовленні скла, ультрамарину, у виготовленні барвників.
Завдяки своїй високій гігроскопічності і нерозчинності в органічних розчинниках, сульфат використовується для їхнього зневоднення.
Примітки
- SODIUM SULFATE
- Вище цієї температури сульфат натрію розкладається.
Джерела
- CRC Handbook of Chemistry and Physics / D. R. Lide. — 86th. — Boca Raton (FL) : CRC Press, 2005. — 2656 p. — ISBN 0-8493-0486-5. (англ.)
- Patnaik P. Handbook of Inorganic Chemicals. — McGraw-Hill, 2003. — 1086 p. — ISBN 0-07-049439-8. (англ.)
- Butts D. Sodium Sulfates // Kirk-Othmer Encyclopedia of Chemical Technology. — 4th. — New York : John Wiley & Sons, 2004. — Vol. 22. — P. 207. — ISBN 978-0-471-48517-9. — DOI: (англ.)
- Helmond von Plessen. Sodium Sulfates // Ullmann's Encyclopedia of Industrial Chemistry. — 6th. — Weinheim : Wiley-VCH, 2005. — P. 1-11. — DOI: (англ.)
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ / Под ред. Р. А. Лидина. — 3-е. — М. : «Химия», 2000. — 480 с. — ISBN 5-7245-1163-0. (рос.)
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2013. — Т. 3 : С — Я. — 644 с.