Тетраетил ортосилікат
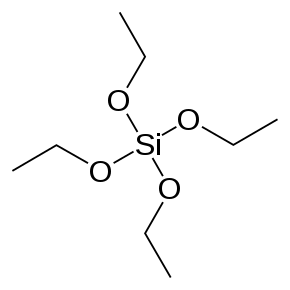
Тетраетил ортосилікат також відомий як тетраетоксисилан, скорочено ТЕОС — хімічна сполука з групи силанів. Етер ортосилікатної кислоти і етилового спирту з формулою Si(OC2H5)4. ТЕОС це безбарвна рідина зі слабким ефірним (пряно-солодкуватим, дещо схожим зі спиртовим) запахом, розчиняється в інертних органічних розчинниках та воді, реагує з вищими спиртами.
| Тетраетил ортосилікат | |
 | |
| Маса | 3,5E−25 кг[1] |
|---|---|
| Хімічна формула | C₈H₂₀O₄Si[1] |
| Канонічна формула SMILES | CCO[Si](OCC)(OCC)OCC[1] |
| Енергія іонізації | 9,77 ± 0,01 електронвольт[2] |
| Густина | 0,93 ± 0,01 г/см³[2] |
| Температура плавлення | −117 ± 1 ℉[2] і −85 °C |
| Точка кипіння | 336 ± 1 ℉[2] |
| Тиск насиченої пари | 1 ± 1 mm Hg[2] |
| Температура спалаху | 99 ± 0 ℉[2] |
| Ідентифікатор PGCH | 0282 |
| Часове середнє значення межі допустимого впливу | 85 ± 1 mg/m³[2] і 850 ± 1 mg/m³[2] |
| IDLH | 5964 ± 1 mg/m³[2] |
Хімічні властивості
Молекула ТЕОС тетраедрична. Як і багато інших аналогів, він виготовляється безпосередньою реакцією тетрахлорсилану з етанолом: SiCl4 + 4EtOH → Si(OEt)4 + 4HCl, де Et — етилова група, C2H5, і EtOH — етанол, відповідно.
При реакції з водою в кислих або основних умовах він гідролізується до силанолів, які негайно конденсуються, утворюючи силікагель.
Si (OC2H5)4 + 2H2O → SiO2 + 4C2H5OH
Ця реакція гідролізу є прикладом процесу золь-гель, побічним продуктом якого є етанол. Реакція протікає через ряд реакцій конденсації, які перетворюють молекулу ТЕОС на мінералоподібну тверду речовину шляхом утворення зв'язків Si-O-Si. Швидкість цього перетворення чутлива до присутності кислот і основ, які служать каталізаторами. Яскравим прикладом є процес Штобера, що дозволяє утворювати монодисперсний та мезопористий діоксид кремнію[4].
За підвищених температур (> 600 °C) ТЕОС перетворюється на діоксид кремнію: Si(OC2H5)4 → SiO2 + 2(C2H5)2O
Летким копродуктом даного процесу є діетиловий етер.
ТЕОС не дуже чутливий до вологи, але має зберігатися в герметичних посудинах, щоб уникнути випадкового гідролізу.
За присутності води і водних розчинів мінеральних кислот відбувається гідроліз тетраетоксисилану з відщепленням етанолу і подальшою конденсацією гідроксипохідних. В залежності від умов гідролізу (температура, тип каталізатора, наявність органічного розчинника) утворення гелю може відбуватися з різною швидкістю.
За присутності різних спиртів (та іноді каталізатора) тетраетоксисилан здатний переетерифіковуватись, приєднуючи молекули спирту з відщеплюванням етанолу. Реакція переетерифікації є оборотною, тому для повноти проходження реакції переетерифікації етанол, як правило, відводиться самостійно або з відповідним азеотропним компонентом.
Застосування
Використовується в стоматології, ювелірній справі та технології кераміки як компонент форми при знятті зліпків.
Є основою для синтезу інших етерів ортосилікатної кислоти шляхом переетерифікації з паралельною відгонкою етилового спирту, що виділяється.
При синтезі кремнійорганічних полімерів застосовують як затверджувач.
Використовується як джерело діоксиду кремнію для синтезу деяких цеолітів[5].
У виробництві аерогелю, при цьому використовують його реакційну здатність до утворення зв'язків Si-OR[6].
Історично використовувався як добавка до ракетного палива на спиртовій основі для зменшення теплового потоку до стінки камери двигунів з регенеративним охолодженням більш ніж на 50 %[7].
Інші застосування:
- Синтез поліетилсилоксанових рідин, отримання діоксиду кремнію особливої чистоти.
- Приготування високоефективних фосфоресцентних і флуоресцентних матеріалів.
- У вигляді гідролізованого продукту — добавка до фарб для підвищення їх адгезії до скла, атмосферо- і теплостійкості.
- У виробництві будівельних матеріалів — для обробки останніх з метою підвищення їх твердості, атмосферо- і водостійкості, поліпшення зовнішнього вигляду і зниження пористості.
- Як зшивний агент у силіконових полімерах та як попередник двоокису кремнію в напівпровідниковій промисловості[8].
- Покриття для килимів та інших предметів.
Примітки
- Tetraethoxysilane
- http://www.cdc.gov/niosh/npg/npgd0282.html
- Stöber, W., A. Fink, and E. Bohn, «Controlled growth of monodisperse silica spheres in the micron size range.» Journal of Colloid and Interface Science, 1968. 26(1): p. 62-69. doi:10.1016/0021-9797(68)90272-5
- Kulprathipanja, Santi (2010) Zeolites in Industrial Separation and Catalysis, Wiley-VCH Verlag GmbH & Co. KGaA, ISBN 3527629572
- Rösch, Lutz; John, Peter and Reitmeier, Rudolf «Silicon Compounds, Organic» in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2002. doi:10.1002/14356007.a24_021
- Clark, John D. (1972). Ignition! An Informal History of Liquid Rocket Propellants. Rutgers University Press. pp. 105—106. ISBN 9780813507255
- Bulla, D.A.P; Morimoto, N.I (1998). «Deposition of thick TEOS PECVD silicon oxide layers for integrated optical waveguide applications». Thin Solid Films. 334: 60. doi:10.1016/S0040-6090(98)01117-1