Акрилова кислота
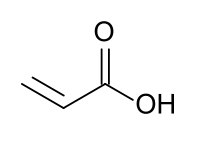
Акри́лова кислота́ СН2=СН−СООН — найпростіша ненасичена карбонова кислота.
| Акрилова кислота | |
|---|---|
 | |
| Ідентифікатори | |
| Номер CAS | 79-10-7 |
| Номер EINECS | 201-177-9 |
| DrugBank | 02579 |
| KEGG | D03397 |
| ChEBI | 18308 |
| RTECS | AS4375000 |
| SMILES |
C=CC(=O)O[1] |
| InChI |
InChI=1S/C3H4O2/c1-2-3(4)5/h2H,1H2,(H,4,5) |
| Номер Бельштейна | 635743 |
| Номер Гмеліна | 1817 |
| Властивості | |
| Молекулярна формула | C3H4O2 |
| Молярна маса | 72,06 г/моль |
| Зовнішній вигляд | безбарвна рідина |
| Густина | 1,051 г/см3 |
| Тпл | 13 °C |
| Ткип | 141,9 °C |
| Розчинність (вода) | необмежено розчинна |
| Кислотність (pKa) | +4,25 |
| Небезпеки | |
| R-фрази | R10, R34 |
| S-фрази | S1, S2, S26, S36, S45 |
| NFPA 704 |
 2
3
2
|
| Температура спалаху | 54 °C |
| Температура самозаймання | 360 °C |
| Вибухові границі | 2,4%-8% |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Фізичні властивості
Безбарвна рідина з гострим запахом, розчиняється у воді та органічних розчинниках.
Добування
Акрилова кислота утворюється при гідролізі акрилонітрилу:
Також можна отримати окисненням акролеїну:
Ще можна отримати карбонілюванням ацетилену:
При взаємодії оксирану з ціановоднем утворюється етиленціангідрин. При його взаємодії з водою та сульфатною кислотою утворюється гідроксипропанова кислота, яка здатна до дегідратації:
Хімічні властивості
Може приєднувати бромоводень. Ця реакція йде не за правилом Марковникова: атом гідрогену приєднується до CH2, а брому — до СН:
Може окиснюватися перманганатом калію. При цьому утворюється 2,3-дигідроксипропанова кислота:
При жорсткому окисненні (нагріванні у розчині перманганату калію або нітратної кислоти) відбувається розрив подвійного зв'язку:
Акрилова кислота та її естери легко полімеризуються внаслідок розриву π-зв'язку:
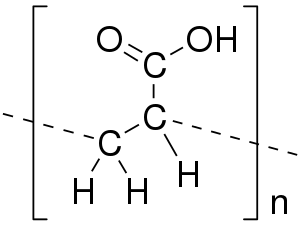
Застосування
Полімери естерів акрилової кислоти використовують у виробництві пластмас та органічного скла.
Примітки
- ACRYLIC ACID
Посилання
- Акрилова кислота // Велика українська енциклопедія : у 30 т. / проф. А. М. Киридон (відп. ред.) та ін. — 2016. — Т. 1 : А — Акц. — 592 с. — ISBN 978-617-7238-39-2.
- (рос.)АКРИЛОВАЯ КИСЛОТА (Международные карты химической безопасности (ICSC))
Література
Ластухін Ю. О., Воронов С. А. Органічна хімія. — 3-є. — Львів : Центр Європи, 2006. — 864 с. — ISBN 966-7022-19-6.
