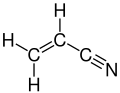
Акрилонітрил
Акри́лонітри́л (віні́лціані́д) — органічна сполука, нітрил акрилової кислоти. Безбарвна, отруйна рідина. Має слабкий запах. Входить до складу полімерів — поліакрилонітрилів — до 0,1%, утворюється при термічній деструкції ряду пластичних мас[1][2].
| Акрилонітрил | |
|---|---|
 |
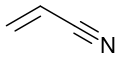 Скелетна формула акрилонітрилу |
 |
 |
| Назва за IUPAC | 2-Пропеннітрил |
| Інші назви | Ціаністий вініл, ціаноетен, нітрил акрилової кислоти |
| Ідентифікатори | |
| Номер CAS | 107-13-1 |
| PubChem | 7855 |
| Номер EINECS | 203-466-5 |
| KEGG | C01998 |
| ChEBI | CHEBI:28217 |
| RTECS | AT5250000 |
| SMILES |
N#CC=C |
| InChI |
InChI=1S/C3H3N/c1-2-3-4/h2H,1H2 |
| Номер Бельштейна | 605310 |
| Властивості | |
| Молекулярна формула | С3Н3N |
| Молярна маса | 53,06 г/моль |
| Молекулярна маса | 53 а. о. м. |
| Зовнішній вигляд | Прозора рідина |
| Запах | дурманний |
| Густина | 0,8060 г/см³ |
| Тпл | −81±1 °C |
| Ткип | 77,6-77,7 °C |
| Розчинність (вода) | 8 % |
| Тиск насиченої пари | 86,9 мм рт. ст. (при 20 °С) |
| Діелектрична проникність (ε) | 38 |
| Показник заломлення (nD) | 1,3884 |
| Дипольний момент | 3,88×10-18 |
| Термохімія | |
| Ст. ентальпія згоряння ΔcH |
7925 ккал/г |
| Теплоємність, c |
0,50±0,03 ккал/(г · °С) |
| Небезпеки | |
| ГДК (Україна) | 0,5 мг/м3 |
| ЛД50 | 78 мг/кг |
| NFPA 704 |
 3
4
2
|
| Температура спалаху | 0±2,5 °C |
| Вибухові границі | 3%-17% |
| Пов'язані речовини | |
| Пов'язані речовини | Пропенова кислота, Акролеїн |
| Якщо не зазначено інше, дані наведено для речовин у стандартному стані (за 25 °C, 100 кПа) | |
| Інструкція з використання шаблону | |
| Примітки картки | |
Застосовується у виробництві синтетичних волокон (нітрону та інших), синтетичного каучуку і полімеризаційних пластмас; у синтезі барвників, лікарських препаратів, пропенової кислоти; як інсектицид і для обкурювання зерна.
Акрилонітрил є подразником, легко всмоктується навіть через непошкоджену шкіру. Токсична дія подібна до дії ціанідів. ГДК в повітрі становить 0,5 мг/м3, у воді водойм — 2 мг/л[3].
Відкриття

Акрилонітрил був відкритий французьким хіміком Шарлем Муре в 1893 році[4]. Він отримував його з етиленціангідрину або з аміду акрилової кислоти шляхом відщеплення води за допомогою оксиду фосфору (V).
Отримання
Отримання через оксиран
Першим промисловим методом стало отримання акрилонітрилу через етиленціангідрин. Останній одержують дією ціанідної кислоти на рідкий оксиран при 50—60 °C в присутності гідроксиду натрію і диетиламіну як каталізаторів[5].
Дегідратація етиленціангідрину проводиться каталітично в рідкій фазі при температурі 200—280 °С або в газовій фазі з активним оксидом алюмінію як каталізатором[6][7][8][9][10]. При роботі в рідкій фазі сталеву ємність для дегідратації, забезпечену потужною мішалкою, заповнюють наполовину технічним етиленіангідрином і 3%-ним оксидом магнію або бокситом і поступово нагрівають до 280 °С. Воду і утворений акрилонітрил безперервно відганяють. У залежності від ступеня відгонки обох компонентів вводять додаткову кількість етиленціангідрину. Через 40 годин реакцію переривають для очищення реакційного котла. Потім дегідратація триває. Для здійснення безперервного процесу потрібно мати декілька реакторів.
Сирий акрилонітрил відокремлюється від води і переганяється з добавками метиленового синього і парафеніленового синього як стабілізаторів. При періодичній перегонці спочатку отримують азеотропну суміш акрилонітрил-вода. Суміш розділяють і шар акрилонітрилу повертають в перегінний куб для видалення слідів води. Вихід чистого акрилонітрилу в перерахунку на вихідний ціангідрин становить 75—78%. Під час перегонки потрібно строго виключати мідь.
Отримання з ацетилену і синильної кислоти
У 1942 році на зміну способу отримання акрилонітрилу через етиленціангідрин прийшов технічно більш досконалий метод виробництва з ацетилену і ціанідної кислоти:
Перша промислова установка була введена в дію фірмою Bayer Leverkusen[11]. Новий метод значно здешевив виробництво акрилонітрилу, який відтоді набув широкого застосування в промисловості. Це досягнення стало можливим завдяки успішним дослідам Петера Курца, перші з яких були проведені в 1939 році на фірмі Bayer Leverkusen[12][13][14]. Курц вводив обидва компоненти — ціанідну кислоту і ацетилен при 75 °С в концентрований водний розчин Cu2Cl2 і NH4Cl (каталізатор Ньюленда). Він отримував вихід акрилонітрилу до 85%. На 1 моль ацетилену потрібно 0,8 моль ціанідної кислоти. Побічними продуктами є етаналь, моно- і дивінілацетилен. Після промивання і перегонки отримують чистий акрилонітрил.
Отримання з пропілену, аміаку (або оксиду азоту) і кисню

У 1949 році фірма Allied Chemical and Dye Corporation повідомила про пряму реакцію перетворення пропілену, аміаку і кисню в акрилонітрил відповідно до рівняння[15]:
Через кілька років фірма Distillers Company Ltd. (Единбург) опублікувала відомості про процес перетворення акролеїну в акрилонітрил взаємодією з аміаком і киснем. Акролеїн отримували окисленням пропілену на повітрі. Це двоступеневий метод отримання акрилонітрилу на відміну від одноступінчатого процесу фірми Allied Chemical and Dye Corporation. Однак обидва процеси дають дуже незначний вихід, тому вони не набули практичного застосування.
На початку 1959 року з'явився відомий тепер у всьому світі процес Sohio американської фірми Standard Oil Co., в якому використовуються ті ж вихідні матеріали — пропілен, аміак, і кисень повітря[16][17][18][19][20][21]. В результаті утворюється акрилонітрил завдяки 50%-ній конверсії пропілену та аміаку. Вже в 1960 році фірма запустила великотоннажну установку.
Акрилонітрил в процесі Sohio утворюється в результаті каталітичного окиснення пропілену на фосфоромолібдаті бісмуту у присутності аміаку. Згодом як каталізатор почали використовувати молібдат бісмуту. Для підвищення виходу в процесі Sohio в реактор вводять водяну пару.
Багато фірм перейшли на процес Sohio або розробили аналогічні процеси. З них особливий інтерес являє метод фірми DuPont з використанням NO[22][23][24][25]:
Інші процеси отримання
Проводилися досліди щодо одержання акрилонітрилу шляхом каталітичної дегідрогенізації пропіонітрилу[26][27]:
Проте даний процес мав настільки малий вихід, а кінцевий продукт містив стільки домішок, що метод не отримав подальшого розвитку.
Те ж стосується методу одержання акрилонітрилу з CH2ClCH2CN за допомогою феноляту натрію[28][29].
Оригінальністю відрізняється спосіб одержання акрилонітрилу окисненням аліламіну в повітрі при 500 °С[30][31]:
Проте в промисловості цей метод також не одержав застосування.
Ще одним цікавим процесом є розроблений в 1955—1960 роки синтез акрилонітрилу з етаналю і ціанідної кислоти через нітрил молочної кислоти[32][33][34][35][36]:
Хімічні властивості
Взаємодія з галогеноводнями і водою
У багатьох випадках галогеноводні, і в першу чергу хлороводень, є специфічними каталізаторами реакцій нітрилів. Роль галогеноводнів при взаємодії нітрилів з водою, спиртами, органічними кислотами, амінами та подібними реагентами в першу чергу полягає в активуванні нуклеофільного приєднання до нітрильного атому Карбону.
Взаємодія нітрилів з хлоридною кислотою може приводити до одержання амідів, але можливості цього методу вельми обмежені. Зручнішим і більш універсальним є метод, що базується на реакції нітрилів з газоподібним хлороводнем і малою (близькою до еквівалентної) кількістю води[37][38]. Проміжними сполуками в цьому синтезі часто є гідрохлориди амідів[39], в результаті гідролізу яких отримують вільні аміди. При обробці газоподібним хлороводнем та водою α, β-ненасичених нітрилів (зокрема акрилонітрилу) одночасно з гідратацією також відбувається гідрохлорування молекули за подвійним зв'язком:
Гідратація в присутності сульфатної кислоти
Гідратація нітрилів у присутності сульфатної кислоти знаходить широке застосування при отриманні амідів α, β-ненасичених кислот. Зокрема гідратація акрилонітрилу під впливом сульфатної кислоти лежить в основі промислових способів отримання аміду[40][41] і ефірів пропенової кислоти. Її проводять дією 50—100%-ї сульфатної кислоти з наступною нейтралізацією.
Гідратація нітрилів найлегше протікає у присутності 75—95%-ної сульфатної кислоти. При значному зменшенні концентрації сульфатної кислоти можливий гідроліз утворених амідів до карбонових кислот. Гідратацію нітрилів можна проводити також у присутності інших сильних неорганічних кислот, наприклад 70%-ної перхлоратної кислоти[42]. Вихід амідів при взаємодії нітрилів з концентрованою сульфатною кислотою залежить від кількості кислоти і зростає зі збільшенням її надлишку[43].
Реакція Радзишевського

У лужних розчинах перекису водню нітрили гідратуються до амідів[44][45][46][47][48]:
Ця реакція називається реакцією Радзишевского[49].
При синтезі амідів методом Радзишевського виділяється значна кількість енергії. Реакції деяких нітрилів (акрилонітрилу, фенілацетонітрилу та, меншою мірою, бензонітрилу) і перекису водню в присутності гідроксиду калію супроводжуються відносно стійкою синьою хемілюмінесценцією[50]. Хемілюмінесценція, очевидно, зумовлена тим, що при гетеролітичному розкладі перекису водню і надкислот кисень виділяється в «синглетному» стані (O=O)[51]. Світіння з'являється при переході кисню з «синглетного» в «триплетний» (•O-O•) стан[52][50].
Гідратація з одночасною обробкою спиртами
Цей спосіб дозволяє одержувати естери безпосередньо з нітрилів. Реакцію здійснюють пропусканням хлороводню через гарячу суміш акрилонітрилу, спирту і води[53][54]. Нагріванням сумішей акрилонітрилу, спирту і води з сульфатною кислотою також можна отримати естери[55][56][57]. Синтез ряду естерів здійснюється шляхом кип'ятіння еквівалентних сумішей акрилонітрилу, води, спирту і n-толуолсульфонової кислоти[58]:
Очевидно, що подібні реакції є багатостадійними. Дуже ймовірно, що вони починаються з гідратації нітрилів і утворення амідів, які далі взаємодіють зі спиртами. Однак експериментальних даних, що підтверджують цю чи якусь іншу схему, поки немає.
Гідроліз
Під гідролізом нітрилів розуміють їх взаємодію з водою, яка приводить до отримання кислот, минаючи стадію виділення первинних продуктів реакції — амідів.
Гідроліз нітрилів є одним із найзручніших способів синтезу карбонових кислот[59]. Його зазвичай здійснюється в кислому або лужному середовищі. У першому випадку виділяються карбонові кислоти, у другому — їх солі.
Кислотний гідроліз
Гідроліз різних нітрилів приводить до утворення відповідних карбонових кислот, зокрема в результаті гідролізу акрилонітрилу утворюється пропенова кислота.
β-Галогенопохідні кислоти отримують з високими виходами також при гідролізі акрилонітрилу в концентрованих водних розчинах галогеноводнів[60].
На напрямок взаємодії акрилонітрилу з водою впливають тривалість і температура реакції. Чим більша тривалість і вища температура реакції, тим більш імовірне перетворення нітрилу в кислоту, а не в амід.
Лужний гідроліз
Гідроліз у присутності гідроксидів металів застосовується на практиці так само широко як і кислотний гідроліз. Як основні реагенти при гідролізі акрилонітрилу застосовуються гідроксиди натрію, калію і барію[61][62]. Швидкість гідролізу зростає із збільшенням концентрації лугу[63]. Як і при гідролізі під дією кислот, в окремих випадках зміна концентрації лугу дозволяє направити реакцію на переважне утворення аміду або кислоти.
Гідроліз акрилонітрилу може протікати і під дією інших основних реагентів, наприклад при його нагріванні з водним розчином аміаку при високій температурі. При такому гідролізі акрилонітрилу аміак одночасно приєднується за подвійним зв'язком. Нагрівання акрилонітрилу з водним аміаком при 150—225 °С є одним із методів одержання β-аланіну (β-амінопропіонової кислоти)[64].
Взаємодія зі спиртами в присутності кислот
У безводному середовищі нітрили реагують зі спиртами та хлороводнем за реакцією Піннера, даючи гідрохлориди іміноефірів[65][66][67]. У випадку акрилонітрилу в умовах цієї реакції відбувається приєднання хлороводню за подвійним зв'язком. В результаті утворюються солі іміноестерів β-хлорпропіонової кислоти[68].
Механізм реакції акрилонітрилу з галогеноводнями і спиртами близький до механізму реакції з водою. Гідрохлориди іміноефірів утворюються через відповідні галогеніди імонійгалогенідів, а також через інші менш стійкі продукти взаємодії нітрилів і галогеноводнів зі спиртами[69].
Продукти реакції акрилонітрилу з хлороводнем і третинними спиртами довгий час не були ідентифіковані[70]. Пізніше було показано, що при взаємодії акрилонітрилу з хлороводнем і третинними спиртами на холоді утворюються хлориди імонійгідринів (гідрохлориди амідів) і трет-алкілхлориди[71].
Взаємодія з органічними кислотами
Обробка сумішей акрилонітрилу і карбонових кислот надлишком хлороводню або бромоводню при кімнатній температурі отримують гідрохлориди амідів, а також ангідриди та галогенангідриди кислот[72][73][74][75].
При нагріванні акрилонітрилу з комплексом BF3·2CH3COOH до 115—120 °C з наступною обробкою реакційної суміші лугом отримують суміш амідів і кислот.
Одержання амідоксимів
На приєднанні гідроксиламіну до ціаногрупи заснований найпоширеніший метод синтезу амідоксимів[76][77][78][79][80]. Незважаючи на те, що ароматичні амідоксими одержуються з більшими виходами ніж незаміщені аліфатичні, взаємодія між акрилонітрилом і гідроксиламіном відбувається з цілком задовільними результатами:
Одержання тіоамідів
У препаративній практиці для одержання тіоамідів часто застосовується реакція нітрилів із сірководнем[81][82][83]. Зокрема для акрилонітрилу вона виглядатиме так:
Синтез тіоаміду здійснюють при кімнатній температурі або при нагріванні до 80—100 °С зазвичай у середовищі органічних розчинників (спирти, бензен, піридин та інші). Відсутність вологи сприяє протіканню реакції. Як каталізатори використовують гідроксиди лужних металів, алкоголяти, третинні аміни (триетиламін, піридин та інші), аміак[84][85]. Для отримання тіоаміду спиртовий розчин акрилонітрилу, що містить аміак, насичують сірководнем і витримують при кімнатній температурі або нагрівають. Оскільки підвищення концентрації сірководню сприяє збільшенню виходу тіоаміду, реакцію іноді проводять під тиском з використанням рідкого сірководню.
Реакція дієнового синтезу
Акрилонітрил реагує з бутадієном своїм подвійним карбон-карбоновим зв'язком з утворенням 4-ціаноциклогексену-1. Реакція протікає шляхом синхронного переносу електронів.
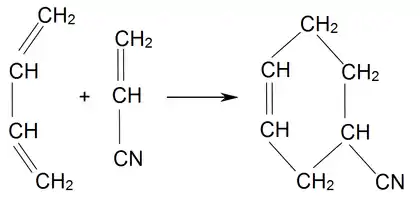
У присутності каталізатора крім ціаноциклогексена утворюється також 2-вінілпіридин[86].
Нітрильна група володіє слабкими дієнофільними властивостями, внаслідок чого дана реакція протікає лише в жорстких умовах.
Відновлення
Акрилонітрил відновлюється до аміну під дією металічного натрію в спирті. Цей процес отримав назву методу Вишнеградського[87][88][89]. Процес протікає за двома реакціями:
Реакція відновлення протікає ступінчасто — через проміжне утворення натрієвої солі аміну.
Також акрилонітрилу притаманне електролітичне відновлення, яке проходить на свинцевому катоді в сильно кислому середовищі. При цьому головним продуктом реакції є аліламін, вихід якого досягає 65—70%[90][91]. Як побічні продукти утворюються пропіламін, пропіонітрил і аміак[92].
Каталітична гідрогенізація
Каталітична гідрогенізація нітрилів, відкрита в 1905 році вченими Полем Сабатьє і Жаном-Баптістом Сандераном[93], є одним із найпоширеніших способів одержання амінів. Внаслідок простоти здійснення, високих швидкостей реакцій та легкості виділення кінцевих продуктів гідрогенізації, метод є незамінним в промисловості. Однак у випадку акрилонітрилу утворення аміну не відбувається, оскільки атомам Гідрогену значно легше приєднатися за подвійним зв'язком:
Полімеризація

В промисловості для одержання поліакрилонітрилу проводять гомогенну (у водних розчинах електролітів) або гетерогенну (у водних емульсіях) радикальну полімеризацію акрилонітрилу. При гомогенній полімеризації як розчинник використовують водні розчини хлориду цинку або роданіду натрію. Процес ведуть до ступеня конверсії мономеру в 50—70%.
У випадку гетерогенної полімеризації як вихідна реакційна суміш використовується водна емульсія акрилонітрилу з вмістом 12—25% мономеру. Особливістю цього процесу є досить висока розчинність акрилонітрилу у воді (~7%), що у присутності водорозчинного ініціатора приводить до протікання реакції полімеризації не тільки на поверхні крапель мономера, а й у водному розчині. Це призводить до самоприскорення процесу аж до ступеня конверсії ~20% і утворення полімеру з широким молекулярно-масовим розподілом. Полімеризацію завершують при ступені конверсії акрилонітрилу в 60—80%, після чого полімер виділяється із суспензії, промивається і сушиться.
У порівнянні з гомогенним процесом при гетерогенній полімеризації виходить полімер з більш високою середньою молекулярною масою.
Радіаційна полімеризація акрилонітрилу проводилась при кімнатній температурі в рідкій фазі і при глибокому охолодженні в твердій фазі[94][95]. Низькотемпературна полімеризація, очевидно, проходить за аніонним механізмом. Отриманий при цьому полімер не містив C=C-зв'язків та містив C=N-зв'язки, тобто при полімеризації розкриваються як подвійні, так і потрійні зв'язки[96].
У рідкому етилені при −78 °С акрилонітрил під впливом γ-випромінювання полімеризується як за подвійними C=C, так і за потрійними C≡N-зв'язками. Продукт реакції складається з полімеру звичайної будови і полімеру зі зв'язками -C-N-. Зі збільшенням концентрації етилену полімеризація за олофіновими C=C-зв'язками інгібується. Полімеризація за C=C-зв'язками, очевидно, протікає за радикальним, а полімеризація за C≡N-зв'язками — за іонним механізмом[97].
Застосування
Завдяки високій реакційній здатності акрилонітрил служить вихідним матеріалом для численних органічних синтезів[98]. Першою великою областю застосування акрилонітрилу була промисловість синтетичного каучуку. У 1930 році були розроблені кополімери з бутадієном, які з'явилися на ринку в 1934 році під торговою назвою пербунан. Основні типи — пербунан (72% бутадієну, 28% акрилонітрилу) і пербунан екстра (60% бутадієну і 40% акрилонітрилу). Наявність нітрильної групи надає вулканізату стійкості до олій і аліфатичних вуглеводнів, проте із збільшенням кількості акрилонітрилу погіршується пружність.
Останнім часом основна кількість акрилонітрилу витрачається на виробництво поліакрилонітрилу, який є вихідним продуктом для поліакрилонітрильних волокон. Переробка в волокна завжди відбувається в розчині. Формування волокна з розплаву нездійсненне через високу температуру плавлення, що перевищує температуру розкладу. Поліакрилонітрильні волокна увійшли в побут під торговими назвами дралон, долан, редан, орлон, акрилан, крезлан, куртель, нітрон, кашмілон та інші.
Сам поліакрилонітрил не представляє великого інтересу. Необхідність поліпшення властивостей полістиролу, насамперед підвищення атмосферостійкості, стійкості до розчинників і ударної в'язкості, призвело до створення ударостійкого полістиролу — кополімеру на основі акрилонітрилу, бутадієну і стирену (АБС)[99], стиролу і акрилонітрилу (САН), значення яких постійно зростає.
Різноманітним є застосування акрилонітрилу при ціаноетилюванні[100]. Він може приєднуватися як до органічних, так і неорганічних сполук.
Акрилонітрил взаємодіє також зі спиртами (в тому числі і високомолекулярними: полівініловим спиртом, крохмалем, целюлозою та іншими), амінами, амідами та іншими. Особливої уваги заслуговує ціаноетилювання деяких натуральних речовин. Приєднання або заміщення галогенів (після гідрування в пропіонітрил) з подальшим омиленням має деяке значення при синтезі гербіцидів α, α, β-трихлорпропіонової кислоти і α, α-дихлорпропіонової кислоти.
Також акрилонітрил використовується у синтезах β-аланіну, ділаурилтіодипропіонової кислоти (антиоксиданти для поліпропілену), пімелінової кислоти.
Фізіологічний вплив
Загальний характер дії
Подібно до неорганічних ціанідів, дія акрилонітрилу пов'язана з відщепленням ціанідної кислоти, яка переходить у роданіди. Молекули акрилонітрилу і ціанідної кислоти майже однаково токсичні (у розрахунку на CN-), але пригнічення активності дихальних ферментів слабша, ніж у HCN. Припускають також, що переважні симптоми ураження нервової системи залежать від дії цілої молекули, яка блокує ферменти з SH-групами. Це підтверджується антидотною дією цистеїну або глутатіону в експериментальних умовах. Акрилонітрил добре всмоктується через шкіру[2].
Вплив на тварин
При гострому отруєнні акрилонітрилом виникає збудження, яке, проте, швидко проходить, відбувається почастішання та різке порушення ритму дихання і рівноваги, блювота, судоми, розширення зіниць, іноді слинотеча (у кішок при концентрації 0,6 мг/л), паралічі, кома, смерть від зупинки дихання. Після повторних отруєнь у собак в крові (швидше) і в сечі (повільніше) зростав вміст роданідів. У щурів і морських свинок запалення і набряк легенів. При концентрації у вдихуваному повітрі 0,216 мг/л у крові собак виявляли ціаніди в кількості 10 мкмоль/100 мл, у щурів 1 мкмоль/100 мл. У мавп при впливі акрилонітрилу протягом 3 і 7 годин знаходили 3,7 і 8,7 мкмоль/100 мл крові[2]. При прояві симптомів отруєння у щурів, морських свинок і кроликів знижувався вміст -груп у крові, головному мозку та печінці[101].
При хронічному отруєнні половина білих щурів, морських свинок, кроликів, кішок гинула після вдихання 0,33 мг/л (по 4 години 5 днів на тиждень протягом 4 тижнів) або 0,22 мг/л — протягом 10 тижнів.
Вплив на людину
Запах акрилонітрилу відчувається при концентрації його в повітрі 0,008—0,04 мг/л, але до нього швидко настає звикання. Вдихання 0,3—0,5 мг/л акрилонітрилу протягом 5—10 хвилин викликає печіння слизових оболонок верхніх дихальних шляхів і сльозотеча. При концентраціях 0,035—0,22 мг/л протягом 20—45 хвилин — тупий головний біль, ниття у грудях, збудження і відчуття страху, свербіння шкіри. Після вдихання 0,048 мг/л протягом 30 хвилин рівень роданидів в крові нормальний; при 0,1 мг/л він підвищувався і не повертався до норми через 12 годин.
Симптоми гострого отруєння: головний біль, слабкість, нудота, блювання, запаморочення, задишка, пітливість, пронос. У важких і смертельних випадках — сильна задишка, судоми, ціаноз, тахікардія, зниження температури тіла, втрата свідомості. На розтині загиблих: сильне кровонаповнення внутрішніх органів, рідка кров, набряк легенів. У ряді випадків при своєчасній антидотовій терапії гострі отруєння закінчуються одужанням. У випадку тривалої втрати свідомості довго зберігаються болі і слабкість в ногах, м'язові посмикування, емоційна нестійкість, хитка хода, погіршення пам'яті, низький артеріальний тиск, порушення рефлексів, брак пульсу на обох ногах — картина ураження центральної нервової системи за типом енцефалополіневриту[102].
При застосуванні акрилонітрилу як інсектициду спостерігалися отруєння осіб, які перебували в оброблених приміщеннях. У легких випадках проявлялись такі симптоми як занепокоєння, слабкість, головний біль, нудота, блювотні рухи, болі в шлунку. Ці явища швидко проходили на свіжому повітрі. Відомі смертельні отруєння дітей, що спали в приміщеннях, недостатньо провітрених після обкурювання акрилонітрилом. У дорослих в цих випадках відзначалися ознаки отруєння, в тому числі подразнення слизових оболонок. Описано смертельний випадок від втирання акрилонітрилу (~50 мл) в шкіру голови 10-річної дівчинки[103].
Тривале вдихання концентрацій акрилонітрилу порядку тисячних часток міліграму на літр у виробничих умовах викликає зниження артеріального тиску, приглушення тонів серця, зниження глоткового рефлексу і підвищення сухожилкових рефлексів. У значної частини працівників виникали атрофічні риніти, іноді парез голосових зв'язок, помірна анемія, лейкопенія з нахилом до лімфоцитозу і моноцитозу. При обстеженні 60 чоловік зі стажем роботи від 1,5 до 3,5 років (концентрація в повітрі робочої зони становила понад 0,5 мг/л) лікарі фіксували скарги на нездужання, слабкість, головний біль, сонливість, дратівливість, брак апетиту, болі в області серця. Крім того фіксувалися зниження електричної активності міокарда (на ЕКГ), неврастенічний синдром з вегетативними порушеннями[103].
При вмісті акрилонітрилу 0,0008—0,0018 мг/л медичні обстеження працівників виробництва синтетичного волокна нітрон виявили порушення в стані здоров'я. У 260 осіб діагностували вегето-судинну дисфункцію і астено-вегетативний та церебро-астенічний синдроми. Клінічне обстеження 50 чоловік зі стажем 3—10 років встановило ті ж зміни нервової системи. У поодиноких випадках відзначені мікросимптоми органічних уражень, дистрофічні порушення в міокарді. Виявлено значну кількість порушень шлунково-кишкового тракту, антитоксичної і білковоутворюючої функції печінки[104].
Примітки
- Wooley M. D., «Fire», 1973, v. 65, № 814, p. 582. (англ.)
- Grahl R. Zentralblatt für Arbeitsmedizin, 1970, Bd. 20, № 12, S. 369–378. (нім.)
- Химическая энциклопедия, под ред. И. Н. Кнунянц, том. І, Москва — «Советская энциклопедия», 1988, с. 71
- Charles Moureu, Annales de chimie, 7, № 2, 187–191 (1894). (фр.)
- F. Erlenmeyer, Liebigs Annalen Chemie, 191, 273(1878). (нім.)
- Німецький патент 299682, 1915. (нім.)
- Німецький патент 679256, 1932. (нім.)
- Французький патент 729952, 1931. (фр.)
- Німецький патент 496372, 1925. (нім.)
- Патент США 2374051, 1941. (англ.)
- Otto Bayer, Angewandte Chemie, 61, 229–241 (1949). (нім.)
- P. Kurtz, Petroleum Refiner, 32, № И, 142–143 (1953). (англ.)
- P. Kurtz, Liebigs Annalen Chemie, 572, 23, 24, 38 (1951). (нім.)
- Німецький патент 728767, 1939. (нім.)
- Патент США 2481826, 1949. (англ.)
- F. Veatch et al., Chemical Engineering Progress, 56, № 10, 65—67 (1960). (англ.)
- Австралійський патент 243791, 1963. (англ.)
- Бельгійський патент 571200, 1958. (фр.)
- Англійський патент 867438, 1960. (англ.)
- Канадський патент 687664, 1964. (англ.)
- Французький патент 1222460, 1965. (фр.)
- Англійський патент 729013, 1955. (англ.)
- Патент США 2736739, 1956. (англ.)
- Патент США 3023226, 1962. (англ.)
- Патент США 3118927, 1964. (англ.)
- Патент США 2385552, 1941. (англ.)
- Німецький патент 51834, 1935. (нім.)
- Французький патент 805563. (фр.)
- Італійський патент 393682, 1941. (італ.)
- L. М. Peters et al., Industrial & Engineering Chemistry, 40, 2046–2053 (1948). (англ.)
- Патент США 2375016, 1940. (англ.)
- R. Burns et al., Journal of the Chemical Society (London), 1935, 400–406. (англ.)
- Патент США 2183357, 1939. (англ.)
- Патент США 2417748, 1943. (англ.)
- Патент США 2417749, 1943. (англ.)
- Англійський патент 424885, 1933. (англ.)
- E. H. Зильберман, Успехи химии, 31, 1309 (1962). (рос.)
- R. C. Thomas jr., C. H. Wang, В. E. Christensen, Journal of the American Chemical Society, 73, 5914 (1951). (англ.)
- G. J. Janz, S. S. Danyluk, Journal of the American Chemical Society, 81, 3850 (1959). (англ.)
- E. L. Carpenter, H. S. Davis, Journal of Applied Chemistry, 7, 671 (1957). (англ.)
- И. A. Якубович, П. И. Парадня, Н. П. Раскин, М. И. Вильямскии, Химическая промышленность, 1963, 570. (рос.)
- A. H. Несмеянов, Л. В. Рыбин, М. И. Рыбинская, Журнал органической химии, 2, 985 (1966). (рос.)
- E. Н. Зильберман, А. А. Мичурин, Э. Г. Померанцева, Известия вузов СССР, Химия и химическая технология, 10, 653 (1967). (рос.)
- J. Deinert, Journal für Praktische Chemie, [2], 52, 431 (1895). (нім.)
- J. V. Dubsky, Journal für Praktische Chemie, [2], 93, 137 (1916). (нім.)
- J. V. Dubsky, Journal of the Chemical Society, 110, 550 (1916). (англ.)
- L. McMaster, F. B. Langreck, Journal of the Chemical Society, 39, 103 (1917). (англ.)
- I. Z. Siemion, Wiadomosci Chemiczne, 19, 275 (1965). (пол.)
- B. Radziszewski, Berichte der Deutschen Chemischen Gesellschaft, 17, 1389 (1884); 18, 355 (1885). (нім.)
- E. McKeown, W. A. Waters, Nature, 203, 1063 (1964). (англ.)
- A. H. Khan, M. Kasha, Journal of Chemical Physics Архівовано 4 травня 2012 у WebCite, 39, 2105 (1963). (англ.)
- E. McKeown, W. A. Waters, Journal of the Chemical Society B, 1966, 1040. (англ.)
- W. Wislicenus, Berichte der Deutschen Chemischen Gesellschaft, 20, 592 (1887). (нім.)
- W. C. Wildman, Journal of the American Chemical Society, 80, 2567 (1958). (англ.)
- L. Spiegel, Berichte der Deutschen Chemischen Gesellschaft, 51, 296 (1918). (нім.)
- A. A. Ross, F. Е. Bibbins, Journal of Industrial and Engineering Chemistry, 29, 1341 (1937). (англ.)
- H. T. Neher, Journal of Industrial and Engineering Chemistry, 28, 267 (1936). (англ.)
- F. L. James, W. H. Bryan, The Journal of Organic Chemistry, 23, 1225 (1958). (англ.)
- V. Migrdichian, The organic cyanogen compunds, Reinhold Publishing Corporation, New York, 1947, p. 37. (англ.)
- A. П. Грищук, C. H. Баранов, Журнал общей химии, 31, 2396 (1961). (рос.)
- H. Leuchs, Berichte der Deutschen Chemischen Gesellschaft, 42, 1232 (1909). (нім.)
- J. Ford, Journal of the American Chemical Society, 67, 876 (1945). (англ.)
- В. A. Липецкий, Б. P. Серебряков, Химическая промы.шленность 1965, 498. (рос.)
- H. Feuer, C. Savides, Journal of the American Chemical Society, 81, 5830 (1959). (англ.)
- R. Roger, D. G. Neilson, Chemical Reviews, 61, 179 (1961). (англ.)
- A. Pinner, F. Klein, Berichte der Deutschen Chemischen Gesellschaft, 10, 1889 (1877). (нім.)
- A. Pinner, Die Imidoaether und ihre Derivate, Oppenheim, Berlin, 1892. (нім.)
- С. С. Price, J. Zomlefer, The Journal of Organic Chemistry, 14, 210 (1949). (англ.)
- E. H. Зильберман, A. E. Куликова, Журнал общей химии, 29, 3039 (1959). (рос.)
- R. H. Hartigan, J. B. Cloke, Journal of the American Chemical Society, 67, 709 (1945). (англ.)
- E. H. Зильберман, A. M. Сладкоп, Журнал общей химии, 31, 245 (1961). (рос.)
- А. Colson, Comptes Rendus Chimie, 121, 1155 (1895). (фр.)
- A. Colson, Annales de chimie et de physique, [7], 12, 231 (1897). (фр.)
- R. Walther, P. G. Schickler, Journal für Praktische Chemie, [2], 55, 305 (1897). (нім.)
- V. Deulofeu, F. Gimenez, The Journal of Organic Chemistry, 15, 460 (1950). (англ.)
- F. Tiemann, Berichte der Deutschen Chemischen Gesellschaft, 17, 126 (1884). (нім.)
- Е. Nordmann, Berichte der Deutschen Chemischen Gesellschaft, 17, 2746 (1884). (нім.)
- J. Tröger, F. Volkmer, Journal für Praktische Chemie, [2], 71, 236 (1905). (нім.)
- F. Eloy, R. Lenders, Chemical Reviews, 62, 155 (1962). (англ.)
- H. C. Brown, С. К. Wetzel, The Journal of Organic Chemistry, ЗО, 3734 (1965). (англ.)
- V. Migrdichian, The chemistry of organic cyanogen compounds, Reinhold Publishing Corporation, New York, 1947, p. 50. (англ.)
- W. Walter, K.-D. Bode, Angewandte Chemie, 78, 517 (1966) (нім.).
- W. Dieckmann, H. Kammerer, Berichte der Deutschen Chemischen Gesellschaft, 38, 2977 (1905). (нім.)
- C. Grundmann, H. Ulrich, The Journal of Organic Chemistry, 24, 272 (1959). (англ.)
- R. N. Hurd, G. Delamater, Chemical Reviews, 61, 45 (1961). (англ.)
- G. J. Janz, N. E. Duncan, Journal of the American Chemical Society, 75, 5389 (1953). (англ.)
- А. Н. Вышнеградский, Журнал Русского химического общества, 12, II, 16 (1880). (рос.)
- A. Ladenburg, Berichte der Deutschen Chemischen Gesellschaft, 18, 2956 (1885). (нім.)
- A. Ladenburg, Berichte der Deutschen Chemischen Gesellschaft, 19, 780 (1886).
- С. Л. Варшавский, А. П. Томилов. Л. В. Каабак, И. Я. Шандринов, авторское свидетельство СССР 181656. (рос.)
- Изобретения, промышленные образцы, товарные знаки, 1966, № 10, 31. (рос.)
- Т. Nonaka, К. Sugino, Journal of The Electrochemical Society, 114, 1255 (1967). (англ.)
- P. Sabatier, J. B. Senderens, Les Comptes Rendus de l'Académie des sciences, 140, 482 (1905). (фр.)
- H. Sobue, Y. Tabata, Journal of Polymer Science, 43, 459 (1960). (англ.)
- С. Л. Сосин, В. В. Коршак, В. Л. Васиев, Е. Л. Баранов, Известия АН СССР, отделение химических наук, 1962, 1644. (рос.)
- Y. Tsuda, Bulletin of the Chemical Society of Japan, 34, 1046 (1961). (англ.)
- Y. Tabata, B. Saito, H. Shibano, H. Sobue, К. Oshima, Kogyo Kagaku Zasshi, 65, 735 (1962). (яп.)
- D. W. McDonald et al., Hydrocarbon Processing Petroleum Refiner, 40, № 7, 149–154 (1961). (англ.)
- Патент США 2439209, 1946. (англ.)
- Н. A. Bruson, Organic Reactions, v. V, N. У., 1949, p, 79. (англ.)
- Hashimolo K., Kanai R. Biochemical Pharmacology, 1972, v. 27, № 5, p. 635–640. (англ.)
- Милков Л, Е., Вартанян К. 3. Гигиена труда, 1969, № 8, с. 51—53. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей. Том II. Органические вещества. Под ред. Н. В. Лазарева и Э. Н. Левиной. Л., «Химия», 1976, с. 106. (рос.)
- Шустов В. Я., Маврина Е. А. Гигиена труда, 1975, № 3, с. 27—29. (рос.)
Джерела
- Українська радянська енциклопедія : у 12 т. / гол. ред. М. П. Бажан ; редкол.: О. К. Антонов та ін. — 2-ге вид. — К. : Головна редакція УРЕ, 1974–1985.
- Андреас Ф., Гребе К. Химия и технология пропилена. — Ленинград : Химия, 1973. — 368 с. (рос.)
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей / Под. ред. Лазарев Н. В. и Левиной Э. Н. — Ленинград : Химия, 1976. — Т. 1. — С. 105—108. — 49000 прим. (рос.)
- Химическая энциклопедия / Под. ред. Кнунянц И. Л. — Москва : Советская энциклопедия, 1988. — Т. 4. (рос.)
- Зильберман Е. Н. Реакции нитрилов. — Москва : Химия, 1972. — 488 с. — 2500 прим. (рос.)
- Dalin M. A., Kolchin I. K., Serebriakov B. R. Acrylonitrile. — Technomic Publication, 1971. — 212 с. (англ.)
- American Cyanamid Company. Petrochemicals Dept. The Chemistry of Acrylonitrile. — s.n, 1959. — 272 с. (англ.)
Посилання
- Акрилонітрил // Велика українська енциклопедія : у 30 т. / проф. А. М. Киридон (відп. ред.) та ін. — 2016. — Т. 1 : А — Акц. — 592 с. — ISBN 978-617-7238-39-2.
|
|
Ця стаття належить до добрих статей української Вікіпедії. |
